
设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g金属镁所含电子数目为0.2NA
B.16gCH4所含原子数目为NA
C.17gNH3所含质子数目为10 NA
D.18g水所含分子数目为18NA
科目:高中化学 来源:2016-2017学年陕西省高二上9月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.铁与稀HNO3 反应:Fe+2H+==Fe2++H2↑
B.大理石溶于醋酸中:CaCO3+2CH3COOH==Ca2++2CH3COO-+CO2↑+H2O
C.氯化钙与碳酸氢钾溶液混合:Ca2++CO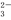 ==CaCO3↓
==CaCO3↓
D.向小苏打溶液中加入过量的澄清石灰水:2HCO +Ca2++2OH-==CaCO3↓+2H2O+CO
+Ca2++2OH-==CaCO3↓+2H2O+CO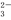
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高二上第一次质检化学卷(解析版) 题型:选择题
可用于电动汽车的铝﹣空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e﹣=4OH﹣
B.以NaOH溶液为电解液时,负极反应为:Al+3OH﹣﹣3e﹣=Al(OH)3↓
C .以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高二上第一次质检化学卷(解析版) 题型:选择题
下列关于焓变ΔH的说法正确的是( )
A.焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.在一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热ΔH为“-”
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高一上月考一化学试卷(解析版) 题型:选择题
下列所含分子数由多到少的排列顺序是
A.标准状况下33.6L H2
B.物质的量为4mol的 H2
C.20℃,45gH2O
D.常温下,16gO2  与14gN2的混合气体
与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海省高一上月考一化学试卷(解析版) 题型:选择题
为了除去粗盐中的CA2+、Mg2+、SO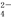 及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量NAOH溶液;③加适量盐酸;④加过量NA2CO3溶液;⑤加过量BACl2溶液。正确的操作顺序可以是( )
及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量NAOH溶液;③加适量盐酸;④加过量NA2CO3溶液;⑤加过量BACl2溶液。正确的操作顺序可以是( )
A.⑤②④③① B.④①②⑤③
C.②⑤④①③ D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一上月考一化学卷(解析版) 题型:选择题
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是( )
A.两种单质A、B的摩尔质量之比是1∶4
B.反应前后的气体质量之比一定是1∶4
C.在生成物C中,A的质量分数为50%
D.C中A、B两元素的原子个数比为3∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一上月考一化学卷(解析版) 题型:选择题
下列关于萃取的操作说法正确的是 ( )
A.从溴水中提取溴,可加入酒精作萃取剂
B.萃取操作完成后,静置分液,上、下层液体均从下口放出
C.用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层
D.萃取时,所加入的溶剂应与原溶剂互不相溶,且与溶质相互间不反应
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:简答题
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
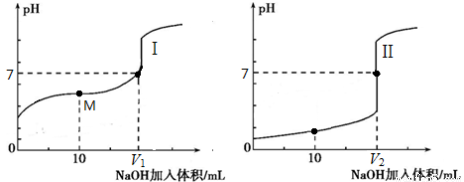
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com