
【题目】等量的苛性钠溶液分别用pH=2和pH=3的醋酸溶液中和,设消耗的醋酸溶液的体积依次为Va、Vb, 则两者的关系正确的为
A. Va >10 Vb B. Vb>10 Va C. Vb<10 Va D. Vb =10Va
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+ N(g)![]() xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
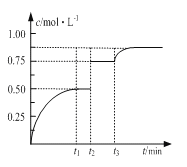
下列说法正确的是
A. 反应方程式中的x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量物质Q
D. t1~t3间该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把Ca(OH)2溶入蒸馏水中,一定时间后达到以下平衡:Ca(OH)2(s)![]() Ca2+ +2OH–,加入以下物质,可使Ca(OH)2(s)减少的是
Ca2+ +2OH–,加入以下物质,可使Ca(OH)2(s)减少的是
A.CaOB.AlCl3C.NaOHD.CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,水的离子积为KW,该温度下将a mol·L-1一元酸HA与b mol·L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中,c(B+)=c(A-)+c(OH-) B. 混合液的pH=7
C. a=b D. 混合液中,c(H+)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HCOOH(甲酸)比NH3H2O电离常数大。向10 mL 0.1mol/L HCOOH中滴加同浓度的氨水,有关叙述正确的是( )
A. 滴加过程中水的电离程度始终增大
B. 当加入10 mL NH3H2O时,c(NH4+) > c(HCOO-)
C. 当两者恰好中和时,溶液pH = 7
D. 滴加过程中n(HCOOH)与n(HCOO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫代硫酸钠(化学式为Na2S2O3 5H20)不溶于乙醇,易溶于水,可用于鞣制皮革、矿石提银、水产养殖、医疗解毒等,工业上常用Na2S、Na2CO3为原料制备,其生产流程如下图所示,回答下列问题。
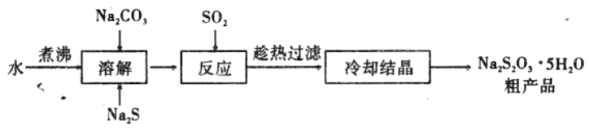
(1)五水硫代硫酸钠中硫元素的化合价为__________。常温下,Na2S溶液的pH_______7(选填“>”、“<”或“=”)。
(2)溶解原料的蒸馏水需加热煮沸一段时间后待用,其目的是____________。
(3)Na2S和Na2CO3按物质的量比2:1投料后加热,将S02缓缓通入溶液中,即可获得 Na2S203,反应的化学方程式为___________________________。
(4)上述制备实验一般须控制在碱性环境下进行,若在酸性条件下产品会发黄,用离子方程式表示其可能的原因___________________________。
(5)充分反应后趁热过滤,将滤液水浴加热浓缩,冷却析出后用乙醇洗涤表面,即可获得纯净的无色透明晶体。趁热过滤和用乙醇洗涤的目的是 ___________________________。
(6)为测定产品中Na2S2O3 5H2O的纯度,准确称取样品质量,用适量的蒸馏水溶解,加入指示剂用已知浓度的碘的标准溶液滴定。
反应原理为:2S2O32-+I2= S4O62-+2I-
①加入的指示剂为______________________(填名称)。
②滴定至终点时,溶液颜色的变化______________________。
③该实验中,滴加标准碘液的操作正确的是________________________________(填图中对应操作的字母编号)。

④下列操作可使产品纯度检测值偏髙的是___________(选填编号)。
a.装标准液的滴定管水洗后未润洗
b.滴定过程中出现漏液
c.滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A.单质分子中一定含有共价键
B.全部由非金属元素组成的化合物不一定是共价化合物
C.非极性键既存在于双原子单质分子中,也可能存在于多原子化合物中
D.氢键是一种特殊的化学键,主要影响物质的熔沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在很多领域有重要的用途,如氧化亚铜(Cu2O)可做半导体材料,胆矾 (CuSO4·5H2O)用于杀菌剂,磷酸氧铜[Cu4O(PO4)2]能充当电极的活性物质。请回答下列相关问题。
(1)写出基态Cu+离子的核外电子排布式____________________,与Cu同周期且与Cu原子最外层电子数相等的元素有______________________(填元素符号)。
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为______________________。
(3)PO43-的VSEPR模型为______________________,中心原子P的杂化类型为 ___________,与其互为等电子体的离子有______________________(写出两种)。
(4)胆矾(CuSO4 5H2O)的结构示意图如下图,请结合示意图完成下列问题。
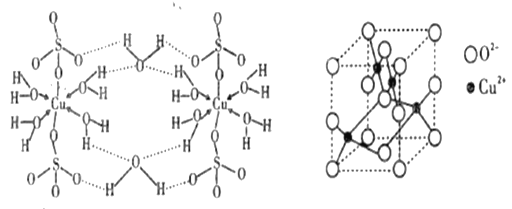
①将胆矾的化学式写成配合物的形式为______________________。
②胆矾中含有的微粒间作用力有______________________(填序号)。
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的__________(填“髙”或“低”),原因是____________________。
②CuO的晶胞结构如上图所示,可确定该晶胞中阴离子的个数为,O2-的配位数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是
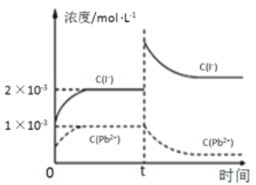
A. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
B. 常温下,PbI2的Ksp为2×10-6
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com