
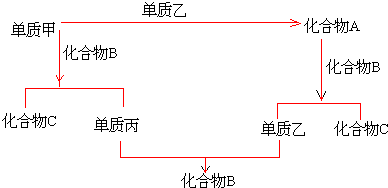
分析 A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,甲与B反应是置换反应,甲与乙是化合反应,丙与乙也是化合反应,单质甲、含有甲元素的化合物A均与化合物B反应得到不同的单质,且两种单质反应又得到化合物B,应是Na、过氧化钠与水的反应,可推知甲是Na单质,乙为氧气,B是H2O,丙为氢气,C是NaOH,A是Na2O2,据此解答.
解答 解:A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,甲与B反应是置换反应,甲与乙是化合反应,丙与乙也是化合反应,单质甲、含有甲元素的化合物A均与化合物B反应得到不同的单质,且两种单质反应又得到化合物B,应是Na、过氧化钠与水的反应,可推知甲是Na单质,乙为氧气,B是H2O,丙为氢气,C是NaOH,A是Na2O2.
(1)由上述分析可知,单质甲必定是金属,故选:1;
(2)单质乙的分子式可能是O2,故选:(A);
(3)化合物A、B、C的分子式分别是:Na2O2、H2O、NaOH,故选:(C).
点评 本题考查无机物推断,基本属于猜测验证型推断,需要学生熟练掌握元素化合物知识,注意抓住短周期元素形成的单质化合物.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
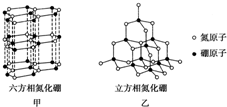 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com