
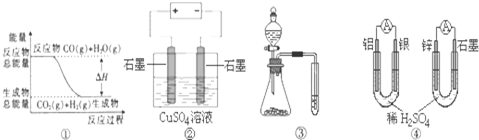
| A. | 图①表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | |
| B. | 图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1 | |
| C. | 图③实验装置可完成比较磷酸、碳酸、苯酚的酸性强弱的实验 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
分析 A.图中反应物能量高于生成物能量;
B.惰性电极电极硫酸铜溶液分两个阶段分析,先电解硫酸铜,再电解水,根据化学方程式计算分析判断;
C.依据试剂加入顺序和反应现象对比比较,酸性强的生成酸性弱的分析;
D.负极分别为Al、Zn,由电子守恒可知2Al~3Zn.
解答 解:A.图中反应物能量高于生成物,反应为放热反应,△H<0,故A错误;
B.惰性电极电解硫酸铜溶液发生的反应为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,阳极生成单质为氧气,阴极生成单质先析出铜,后析出H2,一定时间内,两电极产生单质的物质的量之比不是1:1,故B错误;
C.分液漏斗中为乙酸,与加入锥形瓶中的碳酸钠溶液反应生成气体,说明乙酸酸性强于碳酸,二氧化碳通入苯酚钠溶液变浑浊,说明碳酸酸性强于苯酚,故C正确;
D.负极分别为Al、Zn,由电子守恒可知2Al~3Zn,则通过导线的电子数相同时,消耗负极材料的物质的量不同,故D错误;
故选C.
点评 本题考查化学实验方案的评价,涉及反应前后的能量守恒,电解过程分析,酸性比较的实验设计,原电池等,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
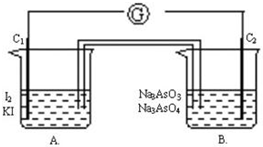 根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.
根据可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如下图所示实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
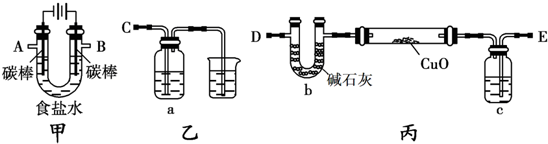
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 强酸性溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3- | |
| D. | 使石蕊变蓝的溶液中:Ba2+、Na+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; .
.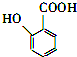 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是 .
.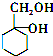 的合成路线流程图(自选无机试剂).合成路线流程图示例:
的合成路线流程图(自选无机试剂).合成路线流程图示例:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,减小压强,A的转化率增大 | |
| B. | 升高温度,减小体积,有利于平衡向正反应方向移动 | |
| C. | 增大A的浓度,平衡正向移动,A的转化率增大 | |
| D. | 降低温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com