
| A. | Cl- | B. | Br- | C. | MnO4- | D. | H2S |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题
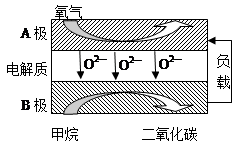
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、AlO2-、Cl-、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
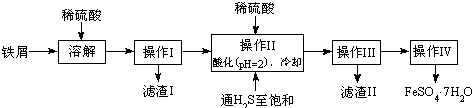
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
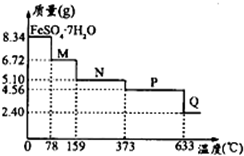
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳极 | 阴极 | 溶液甲 | 物质乙 | |
| A | Pt | Pt | CuCl2 | CuCl2固体 |
| B | Pt | Pt | H2SO4 | H2O |
| C | Pt | Pt | NaCl | 盐酸 |
| D | Pt | Pt | CuSO4 | CuO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25(b-2a)mol/L | B. | 4(2a-b)mol/L | C. | 2(b-2a)mol/L | D. | 4(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
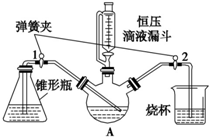 某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CO2(g) | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| 丁 | amol | amol | amol | amol |
| A. | n(丁)>n(甲)>n(乙)>n(丙) | B. | n(丁)>n(甲)>n(丙)>n(乙) | C. | n(丁)>n(乙)>n(丙)>n(甲) | D. | n(丁)>n(乙)>n(甲)>n(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
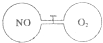 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com