
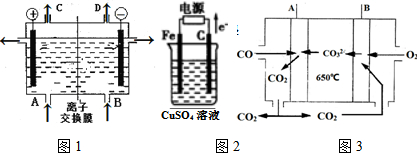
分析 (1)电解饱和食盐水,生成氢气、氯气和氢氧化钠,阳极生成氯气,阴极生成氢气和氢氧化钠,阳离子向阴极移动,A应补充NaCl,B补充水;
(2)根据电子流向判断铁做阴极,石墨做阳极,溶液中氢氧根离子在阳极失电子发生氧化反应;根据电解硫酸铜溶液的反应特征分析判断恢复溶液浓度;
(3)由于保持电解质熔融液的组成、浓度都不变,而在负极上放电的是CO,故应为CO失电子结合CO32-生成CO2;正极上放电的是二氧化碳,二氧化碳结合氧气得到电子生成碳酸根离子,原电池工作时,阴离子向负极移动,据此解答.
解答 解:(1)电解饱和食盐水,生成氢气、氯气和氢氧化钠,电解方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,阳极生成氯气,阴极生成氢气和氢氧化钠,阳离子向阴极移动,A应补充NaCl,B补充水,电解时,阴极生成NaOH,钠离子向以及移动,每通过0.1mol电子,就有0.1molNa+,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;NaCl;H2O;Cl2;H2;Na+;
(2)根据电子流动方向知,石墨是阳极、铁电极是阴极,阳极上氢氧根离子放电,石墨电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电生成铜,阳极上析出氧气、阴极上析出铜,所以相当于析出CuO,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑,pH=1时溶液中氢离子浓度为0.1mol/L,则溶液中n(H2SO4)=0.05mol/L×1L=0.05mol,阴极析出n(Cu)=$\frac{0.05mol}{2}$=0.05mol,根据“析出什么加入什么”原则,根据Cu原子守恒知析出m(CuO)=n(Cu).M(CuO)=0.05mol×80g/mol=4g,也可以加入碳酸铜,其质量=0.05mol×124g/mol=6.2g,
故答案为:4OH--4e-=2H2O+O2↑;2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑;氧化铜(或碳酸铜);4g(或6.2g);
(3)由于保持电解质熔融液的组成、浓度都不变,而在负极上放电的是CO,故应为CO失电子结合CO32-生成CO2:CO-2e-+CO32-=2CO2;
正极上放电的是二氧化碳,二氧化碳结合氧气得到电子生成碳酸根离子,电极反应式为:O2+2CO2+4e-═2CO32-;
故答案为:CO-2e-+CO32-=2CO2;O2+2CO2+4e-═2CO32-.
点评 本题考查了原电池原理,明确电子流向、各个电极上发生的反应是解本题关键,再结合转移电子守恒、原子守恒进行计算,注意(2)题要使溶液恢复原状也可以加入碳酸铜,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
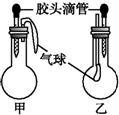 | 甲 | 乙 | |||
| 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| A | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |
| B | NaOH溶液 | 铝 | 硫酸钠溶液 | CO2 | |
| C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 | |
| D | 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO2 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
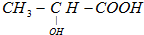 ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.


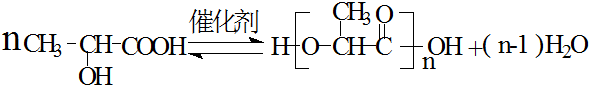 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH一定等于1 | |
| B. | 阴离子肯定有I-,不能确定有无HCO3- | |
| C. | 阳离子肯定没有Fe3+,可能有Na+ | |
| D. | 该溶液含有的溶质成分可能为HI或HI和NaI或NaI和NaOH或NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用电泳现象区分溶液和胶体 | |
| B. | 可以利用胶体的丁达尔效应区分溶液和胶体 | |
| C. | 可以用过滤的方法分离溶液和胶体 | |
| D. | 溶液呈电中性,胶体是带电的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{-H_{20}}$CH3CH=CHCHO,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
$→_{△}^{-H_{20}}$CH3CH=CHCHO,水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com