
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:填空题
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;
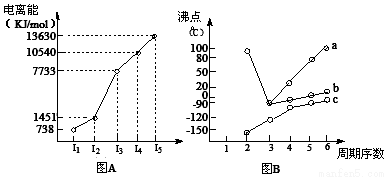
Ⅱ.图B折线c可以表达出第____________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:________________(填“a”或 “b”);
Ⅲ.部分有机物的熔沸点见下表:
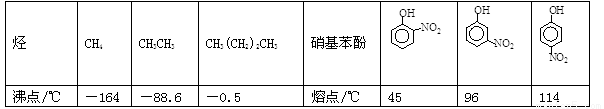
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取__________杂化成键;其中碳氧原子之间共价键含有___________(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为_________________________;
Ⅱ.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的 ,则绿色晶体配合物的化学式为_________________________。
,则绿色晶体配合物的化学式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期10月教学质检理综化学试卷(解析版) 题型:实验题
金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属钼的实验流程图(已知钼酸为难溶于水和酸的黄色晶体):

(1)在灼烧钼矿时发生化学反应:2MoS2+7O2 2MoO3+4SO2,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为______________。
2MoO3+4SO2,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为______________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为______________。
(3)写出步骤②中发生反应的离子方程式______________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化钼,同时检验该反应的氧化产物,根据要求回答下列问题。
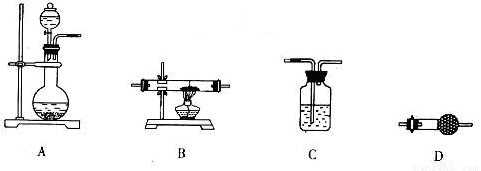
①若两次使用到C装置,则装置D中所盛的药品是___________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后_________→_________→_________→_________(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
(6)化学分析中,常用沉淀法测定金属的含量。若称取三氧化钼粗产品m g,用浓氨水溶解后,再滴加足量的硝酸使其完全转化为钼酸沉淀,此时消耗0.2 mol/L HNO3溶液250mL ,则粗产品中三氧化钼的含量为 (请用含m的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列有关化学概念或原理的论述中,正确的是
A.SO2、NH3的水溶液都能够导电,因此都属于电解质
B.电解饱和食盐水的过程中,水的电离平衡逆向移动
C.任何一个化学反应都可以设计为电池,输出电能
D.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
查看答案和解析>>
科目:高中化学 来源:2016届四川省德阳市高三上学期10月月考理综化学试卷(解析版) 题型:选择题
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
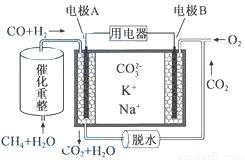
A.反应CH4+H2O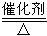 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:实验题
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2。以孔雀石为原料可制备CuSO4·5H2O步骤如下:
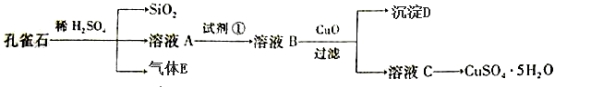
(1)写出孔雀石与稀硫酸反应的化学方程式:_________________________,为了提高原料浸出速率,可采取的措施有___________________(写出两条)。
(2)溶液A的金属离子有Cu2+、Fe2+。实验步骤中试剂①最佳选 (填代号)。
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是__________________ ______。
(4)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3mol/L,必需将溶液pH调节至 。
(5)由溶液C获得CuSO4·5H2O晶体,需要经_____________、___________和过滤。
(6)可用KMnO4标准溶液测定溶液A 中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度_________mol/L(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)。
中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度_________mol/L(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:选择题
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:
2A(g)+3B(g)  2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:
2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得:
v(D)=0.25 mol/(L·min),则下列推断正确的是
A.v(C)=0.2 mol/(L·min) B.z=3
C.B的转化率为25% D.C的体积分数约为28.6%
查看答案和解析>>
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.钠钾合金比纯钠的熔点高
B.鉴别碳酸氢钠中含有纯碱的方法是加热看是否有气体生成
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中必修化学试卷(解析版) 题型:选择题
某无色溶液中存在大量NH4+、H+、Cl-,还可能大量存在的离子是
A.CO32- B.Al3+ C.Cu2+ D.OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com