
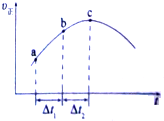
 自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )
自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )| A、反应物浓度:a点小于c点 |
| B、△t1=△t2时氢气的产率:ab段小于bc段 |
| C、该反应的正反应为吸热反应 |
| D、c点反应进行的程度最大 |


科目:高中化学 来源: 题型:
| A、2mol |
| B、1.5mol |
| C、1mol |
| D、0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钠溶液 |
| B、0.1mol?l-1盐酸溶液和0.1mol?l-1氢氧化钡溶液 |
| C、pH=4醋酸溶液和pH=10氢氧化钠溶液 |
| D、pH=4盐酸溶液和pH=10氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R2+ |
| B、R+ |
| C、R3+ |
| D、R4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z、W的原子半径和原子序数都依次增大 |
| B、W、Z、M元素的气态氢化物热稳定性依次增强 |
| C、M分别和Y、Z所形成化合物都可以和碱反应 |
| D、X分别和M、W所形成的化合物含化学键类型一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在高温下,Na2CO3+SiO2=Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3 |
| B、物质的量浓度相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,c(NH4+)的浓度由大到小顺序为:c[(NH4)2SO4]>c[(NH4)2CO3]>c[(NH4)2Fe(SO4)2] |
| C、向1L 0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g时,则溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=0.2 mol/L |
| D、T℃时,饱和Ag2CrO4溶液中的c(Ag+)小于饱和AgCl溶液中的c(Ag+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.3g | B、6.3g |
| C、8.4g | D、13.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com