
下表是相同温度下三种酸的一些数据,下列判断正确的是

A.在相同温度下, >
>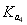 >
>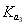
B.室温时,若在NaZ溶液中加水,则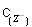 /
/ ·
·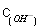 的比值变小,若加少量盐酸,则比值变大
的比值变小,若加少量盐酸,则比值变大
C.等物质的量浓度的NaX、NaY和NaZ的混合溶液,则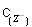 <
<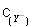 <
<
D.在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且 >
>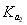 >
>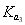 =0.01
=0.01
A
【解析】
试题分析:电离度是弱电解质达到电离平衡时已经电离的电解质分子浓度占电解质分子总浓度的百分比。它不仅以温度有关,还与电解质的浓度有关。电离平衡常数是弱电解质达到电离平衡时电离产生的各种离子浓度的乘积与未电离的电解质分子的浓度的比。它只与温度有关,而与浓度无关。A. ;
; ;
; 所以在相同温度下,
所以在相同温度下,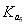 >
> >
> .正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O
.正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下,
HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下,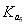 >
> >
> 。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则
。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则 >
> >
> 。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以
。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以 =
= =
=  。错误。
。错误。
考点:考查电离度、电离平衡常数与浓度、温度的关系的知识。


科目:高中化学 来源: 题型:
(10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 ▲ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H= -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 ▲ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H>0,水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是 ▲ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1min—1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市怀柔区高三第二学期适应性练习理综化学试卷(解析版) 题型:填空题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu +
H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H >0
△H >0
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
|
序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
|
① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
|
② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
|
③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三高考模拟(四)理综化学试卷(解析版) 题型:填空题
(13分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu
+ H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
|
① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
|
② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
|
③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省淮安市高三第四次调研测试化学试卷 题型:填空题
(10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu + H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 ▲ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 ▲ 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是 ▲ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min—1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com