
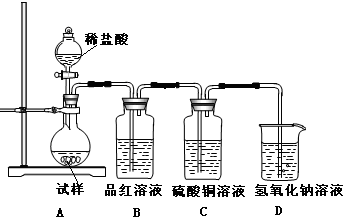
分析 (1)固体不知物质类别,不能判断反应前后的现象分析和质量变化,但分解反应一定有新物质生成;
(2)由题意,Na2SO3要加热到600度以上才分解,生成硫化钠和硫酸钠,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3;
(3)加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,说明加热分解后的固体中含硫化钠和为分解的亚硫酸钠;
(4)加快物质溶解可以搅拌加热等措施,依据题干信息分析判断分解后的固体含有硫酸钠,X为SO42-,依据硫酸根离子的检验方法分析判断;亚硫酸根离子遇硝酸会被氧化为硫酸根;
解答 解:(1)若某种固体物质受热发生了分解,固体不知性质和颜色等:
A.充分加热后不一定有固体残留,如碳酸氢铵分解,故A不符合;
B.加热前后固体颜色不一定无变化,如高锰酸钾溶液前后有元素变化,故B不符合;
C.加热前后固体质量不一定有变化,如亚硫酸钠受热分解生成硫化钠和硫酸钠,因分解产物都是固体,因此反应前后固体质量并没有发生变化,故C不符合;
D.一定生成了新的物质,化学反应一定有新物质变化,故D符合;
E.充分加热后得到的残留固体不一定为混合物,如氯酸钾完全分解生成氯化钾和氧气,故E不符合;
故选D,
故答案为:D;
(2)由题意,Na2SO3要加热到600度以上才分解生成硫化钠和硫酸钠,反应的化学方程式为:4Na2SO3$\frac{\underline{\;600℃\;}}{\;}$Na2S+3Na2SO4,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3 ,向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,
故答案为:4Na2SO3$\frac{\underline{\;600℃\;}}{\;}$Na2S+3Na2SO4,先逐渐增大,后逐渐减小;
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象,
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;B中品红溶液褪色,C中无明显变化;
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).通过实验分析判断,离子为硫酸根离子,确定分解产物为硫化钠和硫酸钠,为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可以用玻璃棒搅拌或加热,检验硫酸根离子是加入盐酸,无变化,再加入氯化钡生成白色沉淀证明是硫酸根离子;甲实验加硝酸,原来溶液中含亚硫酸钠,遇硝酸被氧化为硫酸钠,干扰硫酸根离子的检验,
故答案为:乙;甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO32-;
点评 本题考查了物质性质验证的实验设计和实验分析判断,主要考查硫及其化合物性质的应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
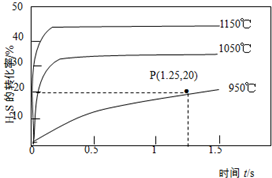 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
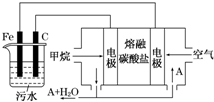 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应Cl2被氧化 | ||
| C. | 该反应不属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Al3+、Mg2+、Cl-、SO42- | |
| B. | 使pH试纸显蓝色的溶液中:Cu2+、Fe2+、NO3-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:K+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、NH4+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
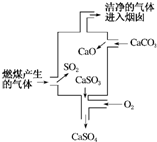
| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com