
【题目】下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
A.①②③④
B.①③④
C.②③④
D.①②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在下列条件下,两种气体的分子数一定相等的是( )
①同质量、不同密度的N2和C2H4 ②同温度、同体积的O2和N2
③不同温度压强下、同物质的量的CO2和C2H4 ④同压强、同体积的N2和O2 .
A.①②
B.②③
C.①③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.还原剂
B.氧化剂
C.既是氧化剂又是还原剂
D.以上均不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业的核心反应是:N2(g)+3H2(g)![]() 2NH3(g)△H=QKJ/mol,能量变化如图所示,回答下列问题:
2NH3(g)△H=QKJ/mol,能量变化如图所示,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1(填“增大”,、“减小”、“不变”,下同);E2-E1_______。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 molN2和l.5 mol H2,充分反应后,放出的热量____46.2KJ。(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_____
A.△H>0,气体分子数目增多
B.△H>0,气体分子数目减少
C.△H<0,气体分子数目增多
D.△H<0 ,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1L 密闭容器中,在500℃ 、2×l07 Pa下达到平衡,测得N2为0.10 mol, H2为0.30 mol, NH3为0.10 mol。计算该条件下达到平衡时H2的转化率_____。若升高温度,K值变化_______(填“增大”、“减小”或“不变)。
(5)在上述(4)反应条件的密闭容器中欲提移合成氨中H2的转化率,下列措施可行的_____(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指( )
A.萃取
B.渗析
C.蒸馏
D.干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】于可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
B. 单位时间内断裂4 mol N—H的同时,断裂6mol O—H,反应达化学平衡状态
C. 达到化学平衡状态后,增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系为2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
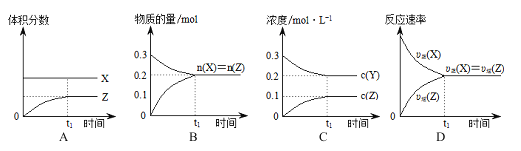
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系 (反应物和产物中的H2O已略去):

(1)Y的电子式为 ,构成E单质的元素在周期表中的位置 。
(2)反应②的离子方程式为 。
(3)足量C通入Y的溶液中可得到一种常见的消毒剂。在该消毒剂中通入少量CO2可得一种酸式盐,从酸性强弱角度请你写出得到的结论: 。
(4)①写出检验N中阳离子常用的试剂名称 ,N也可用来净水,请写出相关离子方程式 。
②H的溶液在空气中久置,会变浑浊,请写出相关离子方程式
(5)C可用来制取漂白粉,为测定漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 (不考虑生成CaSO4):
静置。待完全反应后,用1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题(要写计算过程)
已知反应:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,现有7.4gCa(OH)2与足量的NH4Cl充分反应。求
CaCl2+2NH3↑+2H2O,现有7.4gCa(OH)2与足量的NH4Cl充分反应。求
(1)生成的NH3在标准状况时的体积为多少?
(2)将所得NH3气体溶于100g水中,若所得氨水的密度为0.8g/mL,则该氨水的物质的量浓度为多少?(结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com