
下列各组物质中性质的变化规律排列正确的是
A.微粒半径:Al3 + >Mg2 + >Na + >F -
B.稳定性:HI>HBr>HCl>HF
C.酸性:HClO4>H2SO4>H3PO4>H4SiO4
D.碱性:Ca(OH)2>KOH>Mg(OH)2>Al(OH)3
科目:高中化学 来源: 题型:
某原电池的结构如右图所示,下列有关该原电池的说法中不正确盼是
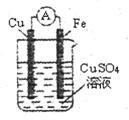 A.铁棒为正极
A.铁棒为正极
B.铜棒发生还原反应
C.电流从铜棒经外电路流向铁棒
D.铁棒质量减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用。甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:
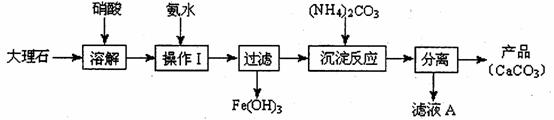
①溶解大理石时,用硝酸而不用硫酸的原因是 。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、 、 。
③“滤液A”中除H+离子外,还含有的阳离子是 ;检验该阳离子的实验方法是:取少量滤液A与 在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:
 2CasO4 2CaO+2S02↑+O2↑。
2CasO4 2CaO+2S02↑+O2↑。
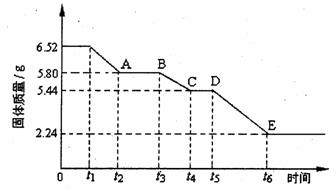
①加热时,该晶体开始发生化学变化的时间是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为 。
③tl~t2时间段固体发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 原子的L层上的电子数为奇数的元素一定是主族元素
B. 同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1
C. 相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类
D. 主族序数等于周期序数的元素一定为金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是
①a-b=m-n ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y
A.②③ B.③
C.①②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
为说明氯比硫的非金属性强,下列事实可作依据的是( )
A.HCl的溶解性强于H2S B.氯的最高价为+7价
C.H2S中的S2-能被Cl2氧化 D.HClO的氧化性强于H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,下列说法正确的是
A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA
B.1mol NH3含有的电子数10NA
C.常温常压下,22.4 L的氧气含氧原子数为2NA
D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com