
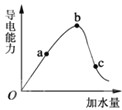
 如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.
如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年吉林省扶余一中高二上学期期末考试化学试卷(带解析) 题型:填空题
(13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。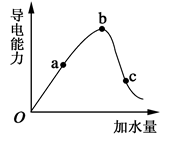
(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二上学期期末考试化学试卷(解析版) 题型:填空题
(13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数
查看答案和解析>>
科目:高中化学 来源:0114 月考题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com