
| A. | 往氯化铝溶液中滴加过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | 往澄清石灰水中通入过量CO2:CO2+OH-=HCO3- | |
| D. | 铁粉和浓盐酸反应:Fe+2H+=Fe2++H2↑ |
分析 A.二者反应生成氢氧化铝沉淀和氯化铵;
B.次氯酸为弱酸,保留化学式;
C.二氧化碳过量反应生成碳酸氢钙;
D.二者反应生成氯化亚铁和氢气.
解答 解:A.往氯化铝溶液中滴加过量氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A正确;
B.氯气通入水中,离子方程式:Cl2+H2O?H++Cl-+HClO,故B错误;
C.往澄清石灰水中通入过量CO2,离子方程式:CO2+OH-=HCO3-,故C正确;
D.铁粉和浓盐酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故D正确;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
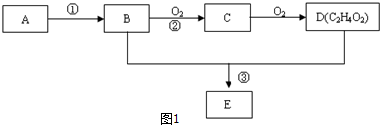
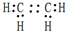 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.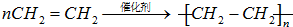 ,反应类型是加聚反应.
,反应类型是加聚反应.
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
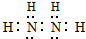 .
. HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
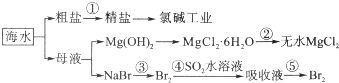
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
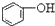 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )| A. | 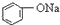 +H2O+CO2→ +H2O+CO2→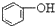 +Na2CO3 +Na2CO3 | B. | 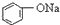 +NaHCO3→ +NaHCO3→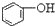 +Na2CO3 +Na2CO3 | ||
| C. | 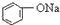 +H2O+CO2→ +H2O+CO2→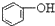 +NaHCO3 +NaHCO3 | D. | 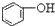 +NaHCO3→ +NaHCO3→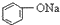 +H2O+CO2 +H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
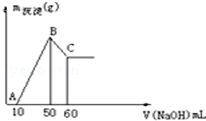 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2和HBrO3均是氧化产物 | |
| B. | BrF3既是氧化剂,又是还原剂 | |
| C. | BrF3的氧化性强于O2 | |
| D. | 反应中,若生成1molBr2,则反应转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com