
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌНЋ3molAКЭ1molBСНжжЦјЬхЛьКЯгкЙЬЖЈШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌЗЂЩњШчЯТЗДгІЃК3A(g)+B(g)![]() xC(g)+2D(s)ЁЃ2minФЉИУЗДгІДяЕНЦНКтЃЌЩњГЩ0.8molDЃЌВЂВтЕУCЕФХЈЖШЮЊ0.2mol/LЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
xC(g)+2D(s)ЁЃ2minФЉИУЗДгІДяЕНЦНКтЃЌЩњГЩ0.8molDЃЌВЂВтЕУCЕФХЈЖШЮЊ0.2mol/LЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
A. ДгПЊЪМЕНЦНКтAЕФЦНОљЗДгІЫйТЪЮЊ0.3mol/(L![]() s)
s)
B. ДгПЊЪМЕНЦНКтBЕФзЊЛЏТЪЮЊ60%
C. ДЫЗДгІЕФЛЏбЇЦНКтГЃЪ§БэДяЪН![]()
D. ШєЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЪБЃЌИУЗДгІвЛЖЈДяЕНЦНКтзДЬЌ
ЁОД№АИЁПD
ЁОНтЮіЁПЪдЬтЗжЮіЃКвЛЖЈЬѕМўЯТЃЌНЋ3molAКЭ1molBСНжжЦјЬхЛьКЯгкЙЬЖЈШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЌЗЂЩњШчЯТЗДгІЃК3A(g)+B(g)![]() xC(g)+2D(s)ЃЌ2minФЉИУЗДгІДяЕНЦНКтЃЌЩњГЩ0.8molDЃЌВЂВтЕУCЕФХЈЖШЮЊ0.2mol/LЃЎвРОнЛЏбЇЦНКтШ§ЖЮЪНСаЪНМЦЫуЃЛ
xC(g)+2D(s)ЃЌ2minФЉИУЗДгІДяЕНЦНКтЃЌЩњГЩ0.8molDЃЌВЂВтЕУCЕФХЈЖШЮЊ0.2mol/LЃЎвРОнЛЏбЇЦНКтШ§ЖЮЪНСаЪНМЦЫуЃЛ
3A(g)+B(g)![]() xC(g)+2D(s)
xC(g)+2D(s)
Ц№ЪМСП(mol) 3 1 0 0
БфЛЏСП(mol) 1.2 0.4 0.4x 0.8
ЦНКтСП(mol) 1.8 0.6 0.4x 0.8
CЕФХЈЖШЮЊ0.2mol/LЃЌCЕФЮяжЪЕФСПЮЊ0.4ЃЌМЦЫуЕУЕНx=1ЃЛAЁЂAЕФЦНОљЗДгІЫйТЪ=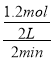 =0.3mol/(Lmin)ЃЌЙЪAДэЮѓЃЛBЁЂBЕФзЊЛЏТЪ=
=0.3mol/(Lmin)ЃЌЙЪAДэЮѓЃЛBЁЂBЕФзЊЛЏТЪ=![]() ЁС100%=40%ЃЌЙЪBДэЮѓЃЛCЁЂDЮЊЙЬЬхЃЌИУЬѕМўЯТДЫЗДгІЕФЛЏбЇЦНКтГЃЪ§=
ЁС100%=40%ЃЌЙЪBДэЮѓЃЛCЁЂDЮЊЙЬЬхЃЌИУЬѕМўЯТДЫЗДгІЕФЛЏбЇЦНКтГЃЪ§=![]() ЃЌЙЪCДэЮѓЃЛDЁЂЗДгІЩњГЩЮяжаКЌгаЙЬЬхЃЌУмЖШЕШгкЦјЬхжЪСПГ§вдЬхЛ§ЃЌЫљвдШєЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЪБЃЌИУЗДгІвЛЖЈДяЕНЦНКтзДЬЌЃЌЙЪDе§ШЗЃЛЙЪбЁDЁЃ
ЃЌЙЪCДэЮѓЃЛDЁЂЗДгІЩњГЩЮяжаКЌгаЙЬЬхЃЌУмЖШЕШгкЦјЬхжЪСПГ§вдЬхЛ§ЃЌЫљвдШєЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЪБЃЌИУЗДгІвЛЖЈДяЕНЦНКтзДЬЌЃЌЙЪDе§ШЗЃЛЙЪбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбЇЯАаЁзщЬНОПХЈЁЂЯЁЯѕЫсбѕЛЏадЕФЯрЖдЧПШѕЕФЃЌАДЯТЭМзАжУНјааЪдбщЃЈМаГжвЧЦївбТдШЅЃЉЁЃЪЕбщБэУїХЈЯѕЫсФмНЋ![]() бѕЛЏГЩ
бѕЛЏГЩ![]() ЃЌЖјЯЁЯѕЫсВЛФмбѕЛЏ
ЃЌЖјЯЁЯѕЫсВЛФмбѕЛЏ![]() ЁЃгЩДЫЕУГіЕФНсТлЪЧХЈЯѕЫсЕФбѕЛЏадЧПгкЯЁЯѕЫсЁЃ
ЁЃгЩДЫЕУГіЕФНсТлЪЧХЈЯѕЫсЕФбѕЛЏадЧПгкЯЁЯѕЫсЁЃ

ПЩбЁвЉЦЗЃКХЈЯѕЫсЁЂ3mo/LЯЁЯѕЫсЁЂеєСѓЫЎЁЂХЈСђЫсЁЂЧтбѕЛЏФЦШмвКМАЖўбѕЛЏЬМ
вбжЊЃКЧтбѕЛЏФЦШмвКВЛгы![]() ЗДгІЃЌФмгы
ЗДгІЃЌФмгы![]() ЗДгІ
ЗДгІ
![]()
ЃЈ1ЃЉ ЪЕбщгІБмУтгаКІЦјЬхХХЗХЕНПеЦјжаЃЌзАжУЂлЁЂЂмЁЂЂожаГЫЗХЕФвЉЦЗвРДЮЪЧ
ЃЈ2ЃЉ ЕЮМгХЈЯѕЫсжЎЧАЕФВйзїЪБМьбщзАжУЕФЦјУмадЃЌМгШывЉЦЗЃЌДђПЊЕЏЛЩМаКѓ
ЃЈ3ЃЉ зАжУЂйжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ
ЃЈ4ЃЉ зАжУЂкЕФзїгУЪЧ ЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ
ЃЈ5ЃЉ ИУаЁзщЕУГіЕФНсТлвЛОжЕФЪдбщЯжЯѓЪЧ
ЃЈ6ЃЉ ЪдбщНсЪјКѓЃЌЭЌбЇУЧЗЂЯжзАжУЂйжаШмвКГЪТЬЩЋЃЌЖјВЛЯдРЖЩЋЁЃМзЭЌбЇШЯЮЊЪЧИУШмвКжаЯѕЫсЭЕФжЪСПЗжЪ§НЯИпЫљжТЃЌЖјввЭЌбЇШЯЮЊЪЧИУШмвКжаШмНтСЫЩњГЩЕФЦјЬхЁЃЭЌбЇУЧЗжБ№ЩцМАСЫвЛЯТ4ИіЪдбщРДХаЖЯСНжжПДЗЈЪЧЗёе§ШЗЁЃетаЉЗНАИжаПЩааЕФЪЧ ЃЈбЁЬюађКХзжФИЃЉ
a. МгШШИУТЬЩЋШмвКЃЌЙлВьбеЩЋБфЛЏ
b. МгЫЎЯЁЪЭТЬЩЋШмвКЃЌЙлВьбеЩЋБфЛЏ
c. ЯђИУТЬЩЋШмвКжаЭЈШыЕЊЦјЃЌЙлВьбеЩЋБфЛЏ
d. ЯђБЅКЭЯѕЫсЭШмвКжаЭЈШыХЈЯѕЫсгыЭЗДгГВњЩњЕФЦјЬхЃЌЙлВьбеЩЋБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДпЛЏЛЙдCO2ЪЧНтОіЮТЪваЇгІМАФмдДЮЪЬтЕФживЊЪжЖЮжЎвЛЁЃбаОПБэУїЃЌдкCu/ZnOДпЛЏМСДцдкЯТЃЌCO2КЭH2ПЩЗЂЩњСНИіЦНКтЗДгІЃЌЗжБ№ЩњГЩCH3OHКЭCOЁЃЗДгІЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
CO2ЃЈgЃЉ+3 H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CO2ЃЈgЃЉ+ H2ЃЈgЃЉ![]() COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
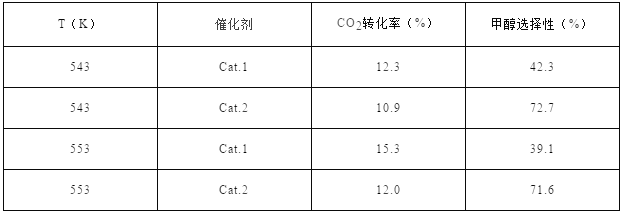
ФГЪЕбщЪвПижЦCO2КЭH2ГѕЪМЭЖСЯБШЮЊ1:2.2ЃЌОЙ§ЯрЭЌЗДгІЪБМфВтЕУШчЯТЪЕбщЪ§ОнЃК

ЁОБИзЂЁПCat.1:Cu/ZnOФЩУзАєЃЛCat.2:Cu/ZnOФЩУзЦЌЃЛМзДМбЁдёадЃКзЊЛЏЕФCO2жаЩњГЩМзШЉЕФАйЗжБШ
вбжЊЃКЂйCOКЭH2ЕФБъзМШМЩеШШЗжБ№ЮЊ-283.0kJЁЄmol-1КЭ-285.8kJЁЄmol-1
ЂкH2OЃЈlЃЉ![]() H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
ЧыЛиД№ЃЈВЛПМТЧЮТЖШЖдІЄHЕФгАЯьЃЉЃК
ЃЈ1ЃЉЗДгІIЕФЦНКтГЃЪ§БэДяЪНK= ЃЛЗДгІIIЕФІЄH2= kJЁЄmol-1ЁЃ
ЃЈ4ЃЉдкЭМжаЗжБ№ЛГіIдкЮоДпЛЏМСЁЂгаCat.1КЭгЩCat.2Ш§жжЧщПіЯТЁАЗДгІЙ§ГЬ-ФмСПЁБЪОвтЭМЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГвКЬЌЬўКЭфхЫЎЗЂЩњМгГЩЗДгІЩњГЩ2ЃЌ3ЉЖўфхЉ2ЉМзЛљЖЁЭщЃЌдђИУЬўЪЧЃЈ ЃЉ
AЃЎ3ЉМзЛљЉ1ЉЖЁЯЉ BЃЎ2ЉМзЛљЉ2ЉЖЁЯЉ
CЃЎ2ЉМзЛљЉ1ЉЖЁЯЉ DЃЎ1ЉМзЛљЉ2ЉЖЁЯЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДпЛЏЛЙдCO2ЪЧНтОіЮТЪваЇгІМАФмдДЮЪЬтЕФживЊЪжЖЮжЎвЛЁЃбаОПБэУїЃЌдкCu/ZnOДпЛЏМСДцдкЯТЃЌCO2КЭH2ПЩЗЂЩњСНИіЦНКтЗДгІЃЌЗжБ№ЩњГЩCH3OHКЭCOЁЃЗДгІЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
CO2ЃЈgЃЉ+3 H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CO2ЃЈgЃЉ+ H2ЃЈgЃЉ![]() COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
ФГЪЕбщЪвПижЦCO2КЭH2ГѕЪМЭЖСЯБШЮЊ1:2.2ЃЌОЙ§ЯрЭЌЗДгІЪБМфВтЕУШчЯТЪЕбщЪ§ОнЃК
ЁОБИзЂЁПCat.1:Cu/ZnOФЩУзАєЃЛCat.2:Cu/ZnOФЩУзЦЌЃЛМзДМбЁдёадЃКзЊЛЏЕФCO2жаЩњГЩМзШЉЕФАйЗжБШ
вбжЊЃКЂйCOКЭH2ЕФБъзМШМЩеШШЗжБ№ЮЊ-283.0kJЁЄmol-1КЭ-285.8kJЁЄmol-1
ЂкH2OЃЈlЃЉ![]() H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
ЧыЛиД№ЃЈВЛПМТЧЮТЖШЖдІЄHЕФгАЯьЃЉЃК
ЃЈ5ЃЉбаОПжЄЪЕЃЌCO2вВПЩдкЫсадЫЎШмвКжаЭЈЙ§ЕчНтЩњГЩМзДМЃЌдђЩњГЩМзДМЕФЗДгІЗЂЩњдк МЋЃЌИУЕчМЋЗДгІЪНЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтФмЪЧЗЂеЙжаЕФаТФмдДЃЌЫќЕФРћгУАќРЈЧтЕФжЦБИЁЂДЂДцКЭгІгУШ§ИіЛЗНкЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгыЦћгЭЯрБШЃЌЧтЦјзїЮЊШМСЯЕФгХЕуЪЧ_________(жСЩйД№ГіСНЕу)ЁЃЕЋЪЧЧтЦјжБНгШМЩеЕФФмСПзЊЛЛТЪдЖЕЭгкШМСЯЕчГиЃЌаДГіМюадЧтбѕШМСЯЕчГиЕФИКМЋЗДгІЪНЃК____________ЁЃ
ЃЈ5ЃЉЛЏЙЄЩњВњЕФИБВњЧтвВЪЧЧтЦјЕФРДдДЁЃЕчНтЗЈжЦШЁгаЙуЗКгУЭОЕФNa2FeO4ЃЌЭЌЪБЛёЕУЧтЦјЃКFe+2H2O+2OH![]() FeO42+3H2ЁќЃЌЙЄзїдРэШчЭМ1ЫљЪОЁЃзАжУЭЈЕчКѓЃЌЬњЕчМЋИННќЩњГЩзЯКьЩЋЕФFeO42ЃЌФјЕчМЋгаЦјХнВњЩњЁЃШєЧтбѕЛЏФЦШмвКХЈЖШЙ§ИпЃЌЬњЕчМЋЧјЛсВњЩњКьКжЩЋЮяжЪЁЃвбжЊЃКNa2FeO4жЛдкЧПМюадЬѕМўЯТЮШЖЈЃЌвзБЛH2ЛЙдЁЃ
FeO42+3H2ЁќЃЌЙЄзїдРэШчЭМ1ЫљЪОЁЃзАжУЭЈЕчКѓЃЌЬњЕчМЋИННќЩњГЩзЯКьЩЋЕФFeO42ЃЌФјЕчМЋгаЦјХнВњЩњЁЃШєЧтбѕЛЏФЦШмвКХЈЖШЙ§ИпЃЌЬњЕчМЋЧјЛсВњЩњКьКжЩЋЮяжЪЁЃвбжЊЃКNa2FeO4жЛдкЧПМюадЬѕМўЯТЮШЖЈЃЌвзБЛH2ЛЙдЁЃ

ЂйЕчНтвЛЖЮЪБМфКѓЃЌc(OH)НЕЕЭЕФЧјгђдк_______(ЬюЁАвѕМЋЪвЁБЛђЁАбєМЋЪвЁБ)ЁЃ
ЂкЕчНтЙ§ГЬжаЃЌаыНЋвѕМЋВњЩњЕФЦјЬхМАЪБХХГіЃЌЦфдвђЪЧ_______ЁЃ
Ђлc( Na2FeO4)ЫцГѕЪМc(NaOH)ЕФБфЛЏШчЭМ2ЃЌШЮбЁMЁЂNСНЕужаЕФвЛЕуЃЌЗжЮіc(Na2FeO4)ЕЭгкзюИпжЕЕФдвђЃК_____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕКЯГЩАБгыжЦБИЯѕЫсвЛАуПЩСЌајЩњВњЃЌСїГЬШчЯТЃК


ЃЈ1ЃЉдкКЯГЩАБЕФЗДгІжаЃЌИФБфЗДгІЬѕМўЃЌЛсЪЙЦНКтЗЂЩњвЦЖЏЁЃШчЯТЭМЯёБэЪОЫцЬѕМўИФБфЃЌАБЦјЕФАйЗжКЌСПЕФБфЛЏЧїЪЦЁЃЕБКсзјБъЮЊбЙЧПЪБЃЌБфЛЏЧїЪЦе§ШЗЕФЪЧЃЈбЁЬюзжФИађКХЃЉ_________ЃЌЕБКсзјБъЮЊЮТЖШЪБЃЌБфЛЏЧїЪЦе§ШЗЕФЪЧЃЈбЁЬюзжФИађКХЃЉ_________ЁЃ
ЃЈ2ЃЉШчЭМЫљЪОШ§ИіШнЛ§ЯрЭЌЕФШнЦїЂйЁЂЂкЁЂЂлЃЌШєЦ№ЪМЮТЖШЯрЭЌЃЌ
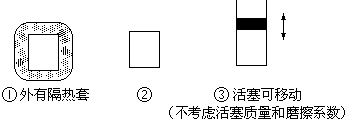
ЗжБ№ЯђШ§ИіШнЦїжаГфШы3mol H2КЭ1mol N2ЃЌвЛЖЈЬѕМўЯТЗДгІЃЌДяЕНЦНКтЪБИїШнЦїжаNH3ЮяжЪЕФАйЗжКЌСПгЩаЁЕНДѓЕФЫГађЮЊЃЈЬюШнЦїБрКХЃЉ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэжаЮяжЪМзЮяжЪвЛЖЈЬѕМўЯТгыввзщжаЕФ4жжЮяжЪЖМФмЗЂЩњЗДгІЕФЪЧЃЈ ЃЉ
бЁЯю | МзЮяжЪ | ввзщжаЕФЮяжЪ |
A | SO2 | ЕэЗлЕтЛЏМиШмвКЁЂАБЫЎЁЂKMnO4ШмвКЁЂЬМЫсФЦШмвК |
B | Mg | Cl2ЁЂCO2ЁЂNH4ClШмвКЁЂNaOHШмвК |
C | SiO2 | ЬМЁЂNaOHШмвКЁЂЧтЗњЫсЁЂNa2CO3 |
D | ЯЁСђЫс | AlЃЈOHЃЉ3ЁЂЬМЁЂCu2ЃЈOHЃЉ2CO3ЁЂCu |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌЗДгІX2ЃЈgЃЉ+H2ЃЈgЃЉ![]() 2HXЃЈgЃЉЕФЦНКтГЃЪ§ЮЊ100ЁЃШєНЋ1.0molЕФHXЃЈgЃЉЭЈШыЬхЛ§ЮЊ1.0LЕФУмБеШнЦїжаЃЌдкИУЮТЖШЪБHXЃЈgЃЉЕФзюДѓЗжНтТЪНгНќгкЃЈ ЃЉ
2HXЃЈgЃЉЕФЦНКтГЃЪ§ЮЊ100ЁЃШєНЋ1.0molЕФHXЃЈgЃЉЭЈШыЬхЛ§ЮЊ1.0LЕФУмБеШнЦїжаЃЌдкИУЮТЖШЪБHXЃЈgЃЉЕФзюДѓЗжНтТЪНгНќгкЃЈ ЃЉ
A. 5% B. 17% C. 25% D. 33%
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com