
【题目】有A、B、C三种常见的短周期元素,它们的取子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:

请回答:
(1) 写出A的最高价的氧化物的电子式___________;C在周期表中的位置____________。
(2) 用有关化学用语解释丙溶液呈碱性的原因____________。
(3) 写出甲溶液与足量乙溶液反应的离子方程式: ____________。
【答案】 ![]() 或
或 ![]() 第三周期 ⅥA族 CO32-+H2O
第三周期 ⅥA族 CO32-+H2O![]() HCO3-+OH- 4H++AlO2―= Al3++2H2O
HCO3-+OH- 4H++AlO2―= Al3++2H2O
【解析】试题分析:A、B、C三种常见的短周期元素,A元素原子最外层电子数是次外层电子数的2倍,则A是C元素;它们的取子序数逐渐增大,B元素原子最外层电子数等于其电子层数,则B是Al元素; C元素原子S元素。甲为含Al的钠盐,甲是NaAlO2,乙为S的最高价氧化物对应的水化物,乙是硫酸;丙为含碳元素的钠盐,丙是碳酸钠。
解析:根据以上分析,(1) A的最高价的氧化物是二氧化碳,二氧化碳的电子式![]() ;16号S元素在周期表中的位置第三周期 ⅥA族。
;16号S元素在周期表中的位置第三周期 ⅥA族。
(2) 碳酸钠水解,碳酸钠溶液呈碱性,离子方程式为CO32-+H2O![]() HCO3-+OH- 。
HCO3-+OH- 。
(3) NaAlO2溶液与足量硫酸反应生成硫酸钠、硫酸铝、水,离子方程式是: 4H++AlO2―= Al3++2H2O


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出电子转移的方向和数目 ________。
(2)该反应中氧化剂与氧化产物物质的量之比是_____。
(3)由该反应判断, KMnO4 的氧化性比 Cl2 的氧化性(选填“强”或“弱”) ________。
(4)如反应中转移了 2mol 电子,则产生的 Cl2 在标准状况下体积为_____L 。
(5)某同学欲用 KMnO4 固体配制100mL 0.5mol/L 的溶液 。回答下列问题:
①配制 KMnO4 溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_____、_____。
②下列对容量瓶及其使用方法的描述中正确的是(请填序号)_____。
A.容量瓶上标有容积、温度和刻线
B.容量瓶用蒸馏水洗净后,必须加热烘干
C.配制溶液时,把量好的 KMnO4 固体小心放入容量瓶中,加入蒸馏水到接近刻度线 1~2 cm 处,改 用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是_______(请填序 号)
A.加水定容时俯视刻度线 B.容量瓶水洗后有水残留
C.颠倒摇匀后发现凹液面低于刻度线又加水补上 D.在溶解过程中有少量液体溅出烧杯外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Ba(OH)2的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如图所示,试回答:

(1)0到a点之间的反应的化学方程式:__________________;
(2)a到b点之间的反应的离子方程式:_____________________;
(3)b点之后的反应的离子方程式:____________________;
(4)c点CO2的体积___ mL(同温同压下);
(5)混合溶液中NaOH和Ba(OH)2的物质的量之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的 CO2 质量进行 计算,某同学设计的实验装置示意图如下:
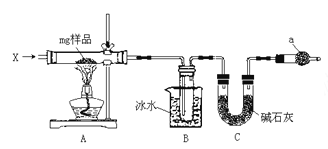
请回答:
(1)仪器 C 的名称是__________;
(2)装置 B 中冰水的作用是__________;
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验 过程中,下列因素可能使碳酸钠的质量分数偏高的是__________。
A.样品分解不完全
B.装置 B、C 之间缺少 CO2 的干燥装置
C.产生 CO2 气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C6H12O6(s)===2C2H5OH(l)+2CO2(g) ΔH1
② 6CO2(g)+6H2O(g)===C6H12O6(s)+6O2(g) ΔH2
③ 2H2O(g) ===2H2(g)+O2(g) ΔH3
④ 2CO2(g)+6H2(g) === C2H5OH(l)+3H2O(g) ΔH4
下列有关说法正确的是( )
A. H2的燃烧热为![]()
B. 反应①使用催化剂,ΔH1将减小
C. 标准状况下,反应②生成1.12 L O2,转移的电子数为0.1×6.02×1023
D. 2ΔH4=ΔH1+ΔH2-6ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B. 电镀时,通常把待镀金属制品作阴极,镀层金属作阳极
C. 常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0
D. 工业通过反应“Na(l)+KCl(l) ![]() NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com