
【题目】下列图示与对应的叙述相符的是
A.如图表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在有无催化剂时的能量变化
2SO3(g) ΔH<0在有无催化剂时的能量变化
B.如图表示电解精炼铜时纯铜和粗铜的质量随时间的变化
C.如图表示铅蓄电池放电时负极质量随转移电子物质的量的变化
D.如图表示反应2NO2(g)![]() N2O4(g)和2NO2(g)
N2O4(g)和2NO2(g)![]() N2O4(l)的能量变化
N2O4(l)的能量变化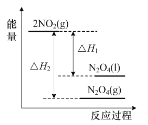
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是
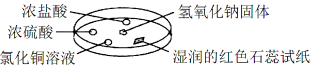
选项 | 实 验 现 象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化铜溶液变白色浑浊 | 白色浑浊的成分是Cu(OH)2 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
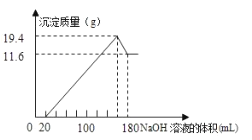
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(1)实验一:用如图所示装置制备并收集 NH3。
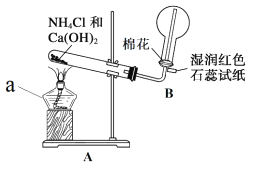
仪器 a 的名称为____________,装置 A 中产生 NH3 的化学方程式为____________, 装置 B 中用圆底烧瓶收集 NH3 的方法为____________(填“向上排空气法”或“向下 排空气法”),当湿润红色石蕊试纸颜色变为____________色,表示已经收集满 NH3。
(2)实验二:用如图所示装置进行 NH3 的喷泉实验。
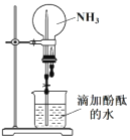
引发该喷泉实验的操作是先____________,再打开止水夹,使烧杯内的水通过导管进入烧瓶形成喷泉,说明 NH3 具有的物理性质是____________,烧瓶内溶液呈红色, 说明 NH3 的水溶液呈____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaOH溶液中通入过量CO2:OH-+CO2=HCO![]()
B.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.SO2水溶液吸收Br2蒸汽:SO2+H2O+Br2=SO![]() +2H++2Br-
+2H++2Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据提供的情境书写指定反应的方程式。
(1)工业上以碳酸锰矿(主要成分为MnCO3,另含少量FeO、Fe2O3、CaO等杂质)为主要原料生产二氧化锰的工艺流程如下:

①“酸浸”时MnCO3发生反应的离子方程式为______。
②“氧化”时MnO![]() 转化为Mn2+,该反应的离子方程式为_____。
转化为Mn2+,该反应的离子方程式为_____。
③“合成MnO2”的化学方程式为______。
(2)氮氧化物是造成大气污染的重要因素。
①在高压下,NO在40 ℃下分解生成两种化合物,体系中各组分的物质的量随时间变化曲线如图所示。NO分解的化学方程式为______。

②一种以乙烯作为还原剂的脱硝(NO)机理示意图如图所示,该脱硝机理总反应的化学方程式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有CuO和Fe2O3组成的混合物ag,向其中加入2 molL﹣1的硫酸溶液50 mL,恰好完全反应。若将ag该混合物在足量H2中加热,使其充分反应,计算冷却后剩余固体质量_________。
(2)取一定量的CuO粉末与0.5 L稀硫酸充分反应后,将一根50 g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24 g。并收集到224 mL气体(标准状况)。求此CuO粉末的质量_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4L CCl4 含有的原子数为 5NA
B.1.8g 的 NH4+中含有的电子数为 NA
C.常温常压下,32 g O2 和 O3 的混合气体中所含原子数为 1.5 NA
D.7.1g Cl2 溶于水,转移电子数目为 0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com