
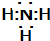 ;
;分析 (1)氯化铵与熟石灰反应生成氯化钙、氨气和水,氨气极易溶于水;N原子有1对孤对电子;
(2)置换反应说明有氮气单质生成,氮气是空气的主要成分;
(3)氨气分解生成氮气和氢气.
解答 解:(1)氯化铵与熟石灰反应生成氯化钙、氨气和水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;氨气极易溶于水可形成喷泉;氨的电子式为 ,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;喷泉;
,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;喷泉;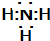 ;
;
(2)置换反应说明有氮气单质生成,氨气与氧气反应生成氮气和水,反应方程式为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6 H2O,氮气是空气的主要成分,该反应无实际用途,故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6 H2O;无;
(3)氨气分解生成氮气和氢气,化学方程式是2 NH3$\frac{\underline{\;放电\;}}{\;}$N2+3H2,故答案为:2 NH3$\frac{\underline{\;放电\;}}{\;}$N2+3H2.
点评 本题考查氮及其化合物的性质,难度不大,侧重于化学方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | NaOH、H2SO4、Ba(OH)2 | D. | NaBr、H2SO4、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
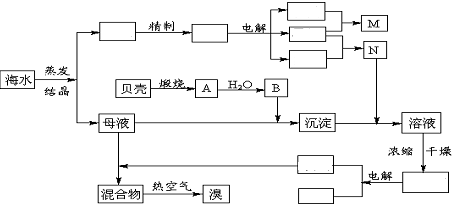
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
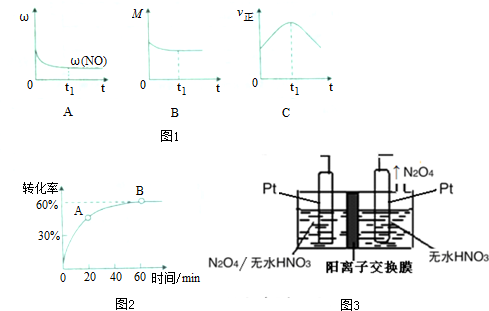
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com