
����Ŀ��ZnO��ҽҩ��ʯ���������й㷺����;���о�С����ij��п��(��Ҫ�ɷ�ZnS������FeS��SiO2��MnCO3������)�Ʊ�����п�����ʣ�����������̣�

��ش��������⣺
(1)����1�Ļ�ѧʽΪ_______����дһ�ָ����ʵ���;��_______________��
(2)����X�Ļ�ѧʽΪ______________��
(3)��ת��������Ҫ��Ӧ�����ӷ���ʽΪ___________________________��
(4)��Ksp(ZnCO3)=1.5��10��10����Һ������Ũ�ȡ�1.0��10��5molL��1ʱ����Ϊ�����ӳ�����ȫ������ʹ1Lc(Zn2+)=1.5molL��1��Һ��Zn2+������ȫ�������������Na2CO3��Һ�����ʵ���Ũ������Ϊ_______________________molL��1 (д����ȷ����������Һ���ʱ����仯���Բ���)��
(5)��һϵ�в������������ˡ�ϴ�ӡ�����������õIJ���������______��ϴ�ӳ����IJ���Ϊ__________________��
���𰸡� SiO2 �Ʋ��������ά Fe(OH)3 MnO4��+3Fe2++7H2O= MnO2��+3Fe(OH)3��+5H+ 3Mn2+ + 2MnO4- + 2H2O = 5MnO2��+ 4H+ 1.5+3��10��5 �ձ���©���������� ��������м�������ˮ��û������������ˮ���º��ظ�����2��3��
����������������п��������ܣ�ֻ�ж������費�����ᣬ��Ϊ������̼�������ᷴӦ���ɶ�����̼���壬��п�����������ᷴӦ�����������壬��ҺΪ����п�������̡����������ȣ����ⱻ��������Ϊ����Һ1������Һ��pH�������Ը��������Һ�����������ӣ����������ӣ����������ӱ�Ϊ������������������������ӱ���ԭΪ�������̳�����ͬʱ������������������ӷ����з�Ӧ���ɶ������̳�������Һ2�к���п���ӣ�����̼���ƺ�����̼��п���壬���պ���������п���ݴ˴��⡣
��⣺(1)�������̿�֪����п����ֻ�ж��������������Ӧ����������1�Ļ�ѧʽΪSiO2 ������������������Ʋ��������ά�ȣ���ȷ�𰸣�SiO2 ���Ʋ��������ά��
(2)��Һ�к����������ӡ����л�ԭ�ԣ��ܹ������Ը��������Һ����Ϊ�����ӣ�������Һ��pHʹ�����ӱ�Ϊ����������������ӻ�ԭΪ�������̹��壬����X�Ļ�ѧʽΪFe(OH)3 ����ȷ�𰸣�Fe(OH)3��
(3)�������ӱ����Ը��������Һ����Ϊ�����ӣ�����������ӻ�ԭΪ�������̣�ͬʱ��Һ�е������������������ӷ������з�Ӧ���ɶ������̹��壬���ӷ���ʽΪ��MnO4��+3Fe2++7H2O= MnO2��+3Fe(OH)3��+5H+�� 3Mn2+ +2MnO4- +2H2O =5MnO2��+4H+ ����ȷ����MnO4��+3Fe2++7H2O= MnO2��+3Fe(OH)3��+5H+�� 3Mn2+ +2MnO4- +2H2O = 5MnO2��+4H+ ��
��4��c(Zn2+)=1.0��10��5molL��1��Ksp(ZnCO3)= c(Zn2+)��c(CO32-)=1.5��10��10���������ݣ��ɵ�c(CO32-)=1.5��10��5 molL��1�������ǵ������ϣ�����ԭ̼������Һ�У�CO32-����Ϊ3��10��5 mol��1L��c(Zn2+)=1.5molL��1��Һ�У�ʹCO32-������������ҪCO32-����Ϊ1.5mol������Na2CO3��Һ�����ʵ���Ũ������Ϊ��3��10��5+1.5��/1=1.5+3��10��5 molL��1����ȷ�𰸣�1.5+3��10��5��
(5) �������õIJ����������ձ���©������������ϴ�ӳ����IJ���Ϊ��������м�������ˮ��û������������ˮ���º��ظ�����2��3�Σ���ȷ�𰸣��ձ���©��������������������м�������ˮ��û������������ˮ���º��ظ�����2��3�Ρ�


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��������Һ�м�������������Һ�������������ʱ�����ӷ�Ӧ�ķ���ʽΪ��Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O
B. �ڷ�H2S+H2SO4(Ũ)=S��+SO2+2H2O�У�ת�Ƶ��ӵ���Ŀ��2NA
C. ����AgCl��KspΪ1.8��10-10����Ag2CrO4��KspΪ1.9��10-12(ǰ�߱Ⱥ��ߴ�)��������Ũ�Ⱦ�Ϊ0.001mol/L��NaCl��K2CrO4�����Һ�еμ�AgNO3��Һ��������Ag2CrO4����
D. ��ͬʱ����3molNa3PO4��2molNaH2PO4��ˮ��Һ�д������º�ȹ�ϵ:2c(PO43-)=3c(H2PO4-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��ͬ��ѧԪ����ɵĻ������ʾ��ͼ�������й������У���ȷ����
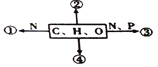
A. ��ͼ�Т�Ϊij�ֻ�����Ļ�����λ�����������Ǻ�����
B. ������Ҫ���������ͼ����ںϳɣ�������������ԭ
C. ����Ϊ�������ӣ����䳹��ˮ��IJ�����4��
D. ���ڴ���������Ƥ�º�����������Χ���������֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ��Targretin(F)�����������Ƥ��T��ϸ���ܰ�������ϳ�·������ͼ��ʾ��
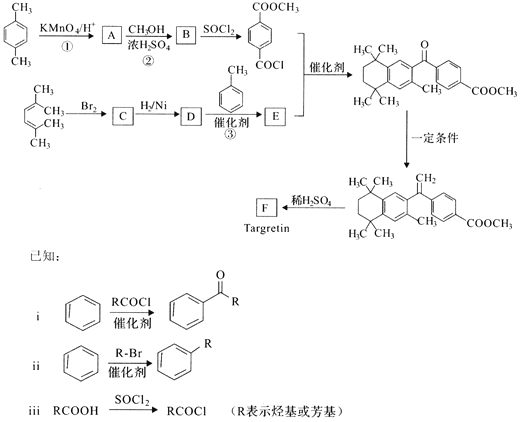
(1)��Ӧ�ٵķ�Ӧ������______________��
(2)��Ӧ�ڵĻ�ѧ����ʽ��__________________________________________��
(3)C�ĺ˴Ź�������ͼ����______________���塣
(4)��Ӧ�۵Ļ�ѧ����ʽ��__________________________________________��
(5)F�ķ���ʽ��C24H28O2. F�к��еĹ����ţ�__________________________��
(6)д��������������A������ͬ���칹��Ľṹ��ʽ�������ǡ�O��O����![]() �ṹ����_______________________________________________________________��
�ṹ����_______________________________________________________________��
a�������ϵ�һ�ȴ��������� b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
(7)��֪��![]() ����2-��������ϩΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�
����2-��������ϩΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�![]() �ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������________��
�ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��������ˮ��Ӧ�����߶���PH3����(�۵�Ϊ-132�棬��ԭ��ǿ������ȼ)����������ʳѬ��ɱ�档������ȫ���涨������ʳ������(��PH3��)�ĺ�������0.05mg��kg-1ʱ��ϸ������·����ⶨ��ʳ�в��������ﺬ����

���������̣���װ����װ�á�PH3�IJ��������ա�ת��KMnO4������Һ���������Ʊ���Һ�ζ���
��ʵ��װ�ã�C��ʢ100 gԭ����D��ʢ�� 20.00 mL 1.12��10-4 mol L-1KMnO4��(H2SO4�ữ)��
��ش��������⣺
(1)����C��������__________________��
(2)������Ϊ����д��������ˮ��Ӧ�Ļ�ѧ����ʽ____________________���������װ�����������õķ�����_____________________________________��
(3)A��ʢװKMnO4��Һ��������______________________��ͨ�������������____________����û��Bװ�ã���ʵ���в��PH3������____________���ƫ�͡�����ƫ�ߡ����䡱��
(4)D��PH3�����������ᣬ��������Ӧ�����ӷ���ʽΪ_________________________��
(5)��D������Һת��������ƿ�У���ˮϡ����250mL��ȡ25.00mL����ƿ�У���5.0��10-5mol L-1��Na2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ11.00mL�����ԭ��������(��PH3��)�ĺ���Ϊ______mg kg-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯīϩ��һ����̼ԭ����������γʷ䳲����Ķ�ά̼���ײ���(��ͼ��),ʯīϩ�в���̼ԭ�ӱ���������ƽ��ṹ�ᷢ���ı䣬ת��Ϊ����ʯīϩ(��ͼ��)��

(1)ͼ���У�1��C������C�γɦҼ��ĸ���Ϊ__________��
(2)ͼ���У�1��C���ӻ���ʽ��__________����C������C�γɵļ���__________(�>������<����=��)ͼ����1��C������C�γɵļ��ǡ�
(3)�ҹ���ī�����ǽ�50nm���ҵ�ʯīϩ������ʯīϩ����ˮ������ͬ���������õ��ķ�ɢϵ���߸�Ϊ�ȶ�����ԭ����____________________��
(4)ʯīϩ��ת��Ϊ����ϩ(C60)��ij����M��C60���Ʊ�һ�ֵ��³������ϣ�������ͼ����ʾ��Mԭ��λ�ھ������������ڲ����þ�����Mԭ�ӵĸ���Ϊ____________���ò��ϵĻ�ѧʽΪ_______________��
(5)���ʯ��ʯī����̼��ͬ�������塣��̼ԭ�Ӱ뾶Ϊr�����ʯ�����ı߳�Ϊa������Ӳ��Ӵ�ģ�ͣ����ʯ������̼ԭ�ӵĿռ�ռ����Ϊ___________��
(6)һ�������£�CH4��CO2������H2O�γ���״�ṹ(����ͼ��ʾ)��ˮ���ᄃ�壬����ز������±���CH4��H2O�γɵ�ˮ���ᄃ���׳ơ���ȼ������

�١���ȼ�����з��Ӽ���ڵ�2����������___________________________��
��Ϊ��������ġ���ȼ�������п�ѧ�������CO2�û�CH4�����롣��֪��ͼ����״�ṹ�Ŀ�ǻֱ��Ϊ0.586nm�����ͼ�������ʽṹ�����ʵĽǶȷ�����������������ǣ�______________________________��
���� ���� | ����ֱ��/nm | ������H2O�Ľ����E/(kJ��mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol/L��ijһԪ��HR��Һ����μ���0.1mol/L��ˮ��������ҺpH�����������仯��ͼ�����з�������ȷ���ǣ� ��

A. a��b�㵼��������ǿ˵��HRΪ����
B. a��b����ʾ��Һ��ˮ�ĵ���̶Ȳ���ͬ
C. bǡ����ȫ�кͣ�pH=7˵��NH4Rû��ˮ��
D. c ����Һ����c��NH4+����c��R-����c��OH-����c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�� F��G�����ڱ��ж����ڵ�����Ԫ�أ��й����ʻ�ṹ��Ϣ���±���
Ԫ�� | �й����ʻ�ṹ��Ϣ |
A | �ؿ��к�������Ԫ�� |
B | B��������A�����ӵ�������ͬ���������������е������Ӱ뾶��С�� |
C | C��Bͬ���ڣ���������������ԭ�Ӱ뾶����(ϡ���������) |
D | Dԭ�������������ǵ��Ӳ�����2�������⻯���г�������ζ |
E | E��Dͬ���ڣ����ڸ�������ԭ�Ӱ뾶��С |
F | F���⻯�������������ˮ���ﷴӦ����һ�����ӻ����� |
G | G���γɻ�������������Ԫ�� |
(1) BԪ�ط���Ϊ____��A��C��ԭ�Ӹ�����Ϊ1��1�γɵĻ�����ĵ���ʽΪ___���õ���ʽ��ʾC��E�γɻ�����Ĺ���____�� D�γɵļ����ӵĽṹʾ��ͼΪ____��
(2) F���⻯������____(���Ի�Ǽ���)���γɵķ��ӣ�д��ʵ�����Ʊ����⻯��Ļ�ѧ����ʽ____��
(3) �ǽ�����D____E(����ڻ�С��)�����ԭ�ӽṹ�ĽǶȽ���ԭ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���NO2 ��SO2 �������1:2 ���ں����ܱ������з�����Ӧ��![]() ��������˵���÷�Ӧ�ﵽƽ��״̬����
��������˵���÷�Ӧ�ﵽƽ��״̬����
A. v(SO3 ) = v(NO2 ) B. ���������ܶȱ��ֲ���
C. ����������ɫ���ֲ��� D. ÿ����1 mol SO3��ͬʱ����1 mol NO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com