
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

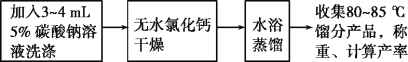
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
【答案】先停止加热,待反应液冷却后再加入沸石 分液漏斗 浓磷酸氧化性比浓硫酸弱,防止浓硫酸氧化有机物 环己醚 降低环己烯在水中的溶解度,减少产品损失 除去产品中少量的磷酸 85%
【解析】
⑴加热过程中,若忘记加沸石,应先停止加热,待反应液冷却后再加入沸石。
⑵由实验流程以及表格中环己醇、浓磷酸、环己烯的溶解性可知,应该用分液漏斗将粗产品分去水层。
⑶浓硫酸的氧化性强,易氧化有机物,因此用浓磷酸代替。
⑷醇可能发生消去反应生成环己烯,也可能发生分子间取代反应,生成环己醚。
⑸因环己烯微溶于水,洗涤时用饱和食盐水可降低环己烯在水中的溶解度,产品中还有残留的磷酸,用5%碳酸钠溶液是为了除去产品中少量的磷酸。
⑹根据关系计算理论产量,再根据实际与理论计算产率。
⑴加热过程中,若忘记加沸石,应先停止加热,待反应液冷却后再加入沸石,故答案为:先停止加热,待反应液冷却后再加入沸石。
⑵由实验流程以及表格中环己醇、浓磷酸、环己烯的溶解性可知,将粗产品分去水层的实验操作为分液,因此所需要用到的主要实验仪器是分液漏斗,故答案为:分液漏斗。
⑶浓硫酸的氧化性强,加热时易氧化有机物,而浓磷酸的氧化性比浓硫酸弱,故使用浓磷酸更好,故答案为:浓磷酸氧化性比浓硫酸弱,防止浓硫酸氧化有机物。
⑷醇在浓磷酸的催化作用下发生消去反应生成环己烯,但同时也可能发生分子间取代反应,生成环己醚,故答案为:环己醚。
⑸因环己烯微溶于水,故洗涤时用饱和食盐水可降低环己烯在水中的溶解度,减少产品损失;因产品中还有残留的磷酸,加入5%碳酸钠溶液是为了除去产品中少量的磷酸;故答案为:降低环己烯在水中的溶解度,减少产品损失;除去产品中少量的磷酸。
⑹加入的环己醇为10.0g,根据以下关系式
环己醇~环己烯
100g 82g
10.0g x
![]() ,解得x = 8.2g,理论上应生成的环己烯为8.2g,反应的产率为
,解得x = 8.2g,理论上应生成的环己烯为8.2g,反应的产率为![]() ×100%≈85%,故答案为:85%。
×100%≈85%,故答案为:85%。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
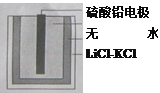
A.正极反应式:Ca+2Cl- - 2e-= CaCl2
B.常温时,在正负极间接上电流表或检流计,指针不偏转
C.放电过程中,Li+向负极移动
D.每转移0.1mol电子,理论上生成20.7g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL0.10molL-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是( )

A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mL
B.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)
C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.键角:BF3>CH4>H2O>NH3
B.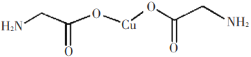 中σ键和π键比例为7:1
中σ键和π键比例为7:1
C.已知二茂铁(Fe(C5H5)2)熔点是173![]() (在100
(在100![]() 时开始升华),沸点是249
时开始升华),沸点是249![]() ,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,
,不溶于水,易溶于苯等非极性溶剂。在二茂铁结构中,![]() 与Fe2+之间是以离子键相结合
与Fe2+之间是以离子键相结合
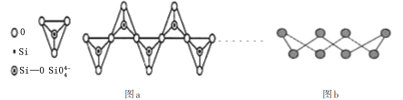
D.在硅酸盐中,![]() 四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图a,其中Si原子的杂化方式与b图中S8单质中S原子的杂化方式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是
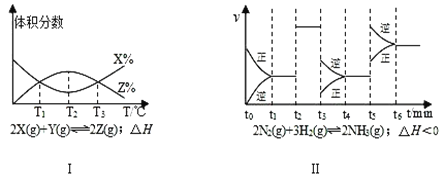
A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-= BaSO4↓
B. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C. SiO2和氢氧化钠溶液的反应:SiO2+2OH-=SiO32-+H2O
D. 用FeCl3溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是( )
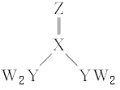
A.YW3的水溶液呈酸性
B.W2Z的稳定性大于YW3
C.YCl3分子中Y原子不是稳定的8电子结构
D.Y元素的氧化物对应的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com