
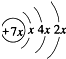 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.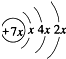 ,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,
,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,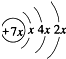 ,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E为Fe元素,
,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E为Fe元素, ,这样排布遵循了泡利不相容原理、洪特规则,
,这样排布遵循了泡利不相容原理、洪特规则, ;泡利;洪特.
;泡利;洪特.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、酸碱中和反应放出的能量可设计为原电池转化为电能 |
| B、煤燃烧是化学能转换为热能 |
| C、太阳能热水器是利用太阳能转化为热能 |
| D、可充电电池在充电时是电能转换为化学能,而放电时是化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应为放热反应 |
| B、正反应为吸热反应 |
| C、A为气体,C为固体 |
| D、A为固体,C为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.查看答案和解析>>
科目:高中化学 来源: 题型:
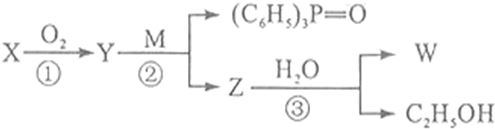
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
| A、离子半径从小到大的顺序:Y<Z<T<X |
| B、X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同 |
| C、T的氢化物是同族元素氢化物中沸点最低的 |
| D、X的最高价氧化物对应的水化物是无机含氧酸中的最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com