
分析 (1)6.4克铜与适量的浓硝酸反应,当铜完全溶解后,产物是硝酸铜和一氧化氮、二氧化氮,根据原子守恒,还原的HNO3的物质的量就等于生成的NO和NO2的物质的量的和;
(2)根据电子转移守恒与混合气体总体积列方程计算各自物质的量,相同条件下气体体积之比等于其物质的量之比.
解答 解:(1)因HNO3中+5价的N被还原成NO中的+2价和NO2中的+4价,说明HNO3中的N得到了电子,Cu是被氧化的,失去了电子,这个过程中,得失电子守恒,即HNO3中N得到的电子=Cu失去的电子,产生的还原产物NO和NO2总共2.24L(标况),所以产生的NO和NO2总的物质的量是2.24/22.4=0.1mol,无论HNO3和Cu反应生成NO也好,NO2也好,总之,发生氧化还原反应的N元素是守恒的,HNO3→NO,HNO3→NO2,是一一对应的(只看N元素守恒),还原的HNO3的物质的量,就等于生成的NO和NO2的物质的量的和为0.1mol,故答案为:0.1mol;
(2)6.4gCu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,则转移电子为0.1mol×2=0.2mol,生成混合气体总物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
设NO2、NO的物质的量分别为xmol、ymol,则:x+y=0.1,x+3y=0.2,解得x=0.05,y=0.05,故NO2、NO的体积分别是:0.05mol×22.4L/mol=1.12L.
故答案为:1.12;1.12.
点评 本题考查混合物计算、氧化还原反应计算,侧重考查学生分析计算能力与解题方法技巧,注意理解掌握原子守恒与电子转移守恒在化学计算中应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列说法正确的是
A.标准状况下44.8L乙醇含有氢原子数为12NA
B.1mol气体的体积只有在标准状况下才是22.4L
C.常温常压下,等质量的N2和N4中所含氮原子数相同
D.标准状况下,1.12L CO和N2的混合气体含有约6.02×1022个分子
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
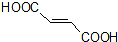 的合成路线如下:
的合成路线如下: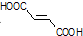
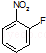 中含有的官能团名称为硝基,氟原子.
中含有的官能团名称为硝基,氟原子.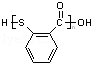 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应 | |
| C. | [浓度1]中a=0.05 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com