
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如右图所示,回答下列问题:
(1)A、B、C、D四点化学反应速率快慢的顺序为________。
(2)解释反应速率变化的原因______________________________
____________________________________________________________________。
(3)计算过氧化氢的初始物质的量浓度___________________________________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
科目:高中化学 来源: 题型:
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题。

(1)指出上图中的各处错误:
①________________________________________________ ________________________;
________________________;
②________________________________________________________________________;
③________________________________________________________________________;
④________________________________________________________________________。
(2)在改过后的装置中,写出下列物质的作用:
①饱和食盐水_________________________________________________________________;
②浓硫酸________________________________________________________________________;
③NaOH溶液 _____________________________________________________。
_____________________________________________________。
(3)在改正过的装置中,制取氯气所发生反应的离子方程式:
________________________________________________________________________,
用NaOH 溶液吸收多余尾气的离子方程式:____________________________。
溶液吸收多余尾气的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硅基太阳电池需用化合物甲作钝化材料,甲 的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下:
的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下:

请回答下列问题:
(1)乙的电子式是 ;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是 。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有 (填字母编号)。
A.O2 B.H2  C.N2 D.CO2 E.Ar
C.N2 D.CO2 E.Ar
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式 。请设计验证产物盐M的实验方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)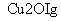
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )
A.前20 min内的反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:

(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3的说法不正确的是 ( )
2SO3的说法不正确的是 ( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
某高分子化合物的部分结构如下,下列说法不正确的是( )

A.聚合物的链节是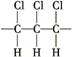
B.聚合物的分子式是(C2H2Cl2)n
C.聚合物的单体是CHCl CHCl
CHCl
D.若n为聚合度,则其相对分子质量为97n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com