
【题目】下列有关实验说法,不正确的是( )
A.碱液不慎溅到手上,先用大量水冲洗,再用饱和硼酸溶液洗,最后用水冲洗
B.![]() 和
和![]() 的混合物经溶解、过滤,洗涤、干燥,可分离出
的混合物经溶解、过滤,洗涤、干燥,可分离出![]()
C.用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D.火柴头的浸泡液中滴加![]() 溶液,稀
溶液,稀![]() 和
和![]() 溶液,可检验火柴头是否含有氯元素
溶液,可检验火柴头是否含有氯元素
【答案】C
【解析】
A. 若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,避免皮肤受损,故A正确;
B.二氧化锰不溶于水,氯化钾可溶于水,所以混合物经溶解、过滤,洗涤、干燥,可分离出![]() ,故B正确;
,故B正确;
C.滴管吸出的液体中含有溶质,因此会导致所配溶液浓度偏小,正确操作应该是重新配制,故C错误;
D. 火柴头中含有KClO3,检验氯元素,应把ClO3-还原为4Cl-,酸性条件下,NO2-具有还原性,向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,发生的离子反应为:ClO3-+3NO2-+Ag+═AgCl↓+3NO3-,出现白色沉淀,证明含有氯元素,故D正确;
故答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】H2A是二元弱酸,25℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1的H2A和NaOH混合溶液,溶液中H2A、HA-和A2-所占三种粒子总数的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
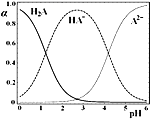
A.c(Na+)=0.1mol·L-1的溶液中:c(H+)=c(A2-)+c(OH-)-c(H2A)
B.c (HA-)=c(A2-)的溶液中:c(Na+)>3c(A2-)
C.c (HA-)=0.5mol·L-1的溶液中:2c(H2A)+c(H+)=c(OH-)+1.5mol·L-1
D.pH=2的溶液中:c(HA-)+2c(A2-)<0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音。波立维属于硫酸氢盐,它的结构如图所示。下列关于它的说法正确的是()
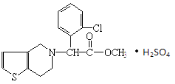
A.该物质的化学式为C16H15ClNO2·H2SO4
B.1mol该物质最多可与6mol氢气反应
C.波立维能形成硫酸氢盐是与其结构中的氮原子有关
D.该有机物可以发生氧化、还原、加成、取代、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A.氧化铁溶于氢碘酸:Fe2O3+6H+===2Fe3++3H2O
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=== AlO2-+4NH4++2H2O
D.向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为_________,从结构角度来看,Fe2+易被氧化成Fe3+的原因是________________。
(2)SCN-离子可用于 Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与 SCN-互为等电子体的一种微粒_____(分子或离子);
②硫氰酸分子中硫原子的杂化方式为_____。
③异硫氰酸的沸点比硫氰酸沸点高的原因是____________________________。
(3)新制的Cu(OH)2可溶于过量的氨水,生成的配合物[Cu(NH3)4](OH)2中含有的化学键类型有 _____________________,1 mol该物质中含有 ____________________个σ键。
(4)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为 ______________pm(列出计算式即可)。
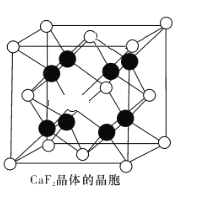
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2+4HCl![]() 2Cl2 +2H2O。
2Cl2 +2H2O。
完成下列填空:
(1)该反应化学平衡常数K的表达式为___;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是___反应(填“吸热”或者“放热”)。
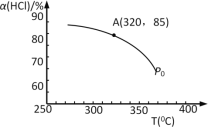
(2)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线___,并简要说明理由:___。
(3)该反应在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)=___mol。
(4)对该反应达到平衡后,以下分析正确的是___(选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5)氯元素能形成多种离子。在水溶液中1molCl-、1molClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的化学方程式(用离子符号表示)___;若有1.5molB发生反应,转移电子___mol。
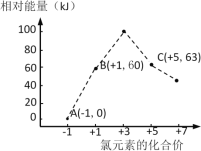
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
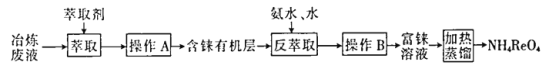
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )
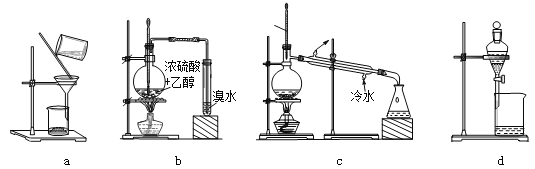
A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰(图甲)中含共价键数目为4NA
B.12g金刚石(图乙)中含有σ键数目为4NA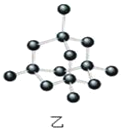
C.44g干冰(图丙)中含有NA个晶胞结构单元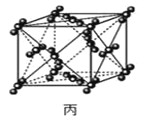
D.12g石墨(图丁)中含σ键数目3NA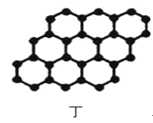
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com