
【题目】蛇纹石矿可以看做是由MgO、![]() 、
、![]() 、
、![]() 组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
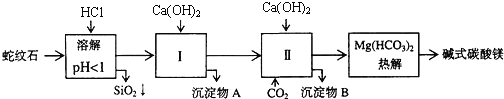
氢氧化物 |
|
|
|
开始沉淀pH |
|
|
|
(1)蛇纹石矿加盐酸溶解后,溶液里除了![]() 外,还含有的金属离子是 ______
外,还含有的金属离子是 ______
(2)进行Ⅰ操作时,控制溶液![]() 有关氢氧化物沉淀的pH见上表
有关氢氧化物沉淀的pH见上表![]() 不能过量,若
不能过量,若![]() 过量可能会导致 ______ 溶解、 ______ 沉淀生成.
过量可能会导致 ______ 溶解、 ______ 沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入 ______ ![]() 填入物质的化学式
填入物质的化学式![]() ,然后 ______
,然后 ______ ![]() 依次填写实验操作名称
依次填写实验操作名称![]() .
.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是 ______ ![]() 填写物质化学式
填写物质化学式![]() .
.
(5)若热分解不完全,所得碱式碳酸镁中将混有![]() ,则产品中镁的质量分数 ______
,则产品中镁的质量分数 ______ ![]() 填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于
填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于![]() .
.
【答案】![]() 、
、![]()
![]()
![]() NaOH 过滤、洗涤、灼烧
NaOH 过滤、洗涤、灼烧 ![]() 或
或![]() 升高
升高
【解析】
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,酸溶过滤得到滤液中为Mg2+、Fe3+、Al3+,加入氢氧化钙沉淀得到氢氧化铝、氢氧化铁沉淀A,滤液中通入二氧化碳生成氢氧化铝沉淀B和碳酸氢钙,加入氢氧化钙反应生成碳酸钙循环利用,溶液中得到碳酸氢镁溶液,热解得到碱式碳酸镁;
(1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)当氢氧化钙过量时,溶液碱性增强,Al(OH)3会溶解,从氢氧化物沉淀的pH表中可看出,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀;
(3)红色氧化物为Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质;
(4)此过程中CO2是可以重复使用的;
(5)根据同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大分析。
蛇纹石矿可以看作由MgO、![]() 、
、![]() 、
、![]() 组成,酸溶过滤得到滤液中为
组成,酸溶过滤得到滤液中为![]() 、
、![]() 、
、![]() ,加入氢氧化钙沉淀得到氢氧化铝、氢氧化铁沉淀A,滤液中通入二氧化碳生成氢氧化铝沉淀B和碳酸氢钙,加入氢氧化钙反应生成碳酸钙循环利用,溶液中得到碳酸氢镁溶液,热解得到碱式碳酸镁;
,加入氢氧化钙沉淀得到氢氧化铝、氢氧化铁沉淀A,滤液中通入二氧化碳生成氢氧化铝沉淀B和碳酸氢钙,加入氢氧化钙反应生成碳酸钙循环利用,溶液中得到碳酸氢镁溶液,热解得到碱式碳酸镁;
![]() 蛇纹石加盐酸溶解,MgO、
蛇纹石加盐酸溶解,MgO、![]() 、
、![]() 和HCl反应溶解,反应方程式分别为:
和HCl反应溶解,反应方程式分别为:![]() ,
,![]() ,
,![]() 而
而![]() 不与盐酸反应,以沉淀的形式除去;
不与盐酸反应,以沉淀的形式除去;
![]() 由
由![]() 知,此时溶液中除了
知,此时溶液中除了![]() 外,还含有
外,还含有![]() 、
、![]() 杂质,需除去
杂质,需除去![]() 、
、![]() 但不能损失
但不能损失![]() ,因
,因![]() 和
和![]() ,利用平衡移动的原理,消耗
,利用平衡移动的原理,消耗![]() 使上述水解平衡向正反应方向移动,除去
使上述水解平衡向正反应方向移动,除去![]() 、
、![]() ,加
,加![]() 需将溶液的pH控制在
需将溶液的pH控制在![]() ,若pH过高,会导致生成的
,若pH过高,会导致生成的![]() 发生反应
发生反应![]() 溶解,
溶解,![]() 在pH为
在pH为![]() 时开始沉淀,所以碱性增强
时开始沉淀,所以碱性增强![]() 会沉淀,同时
会沉淀,同时![]() 也因转化为沉淀而损失;
也因转化为沉淀而损失;
![]() 从实验步骤图知:沉淀混合物为
从实验步骤图知:沉淀混合物为![]() 和
和![]() ,红色氧化物是沉淀物
,红色氧化物是沉淀物![]() 分解后得到的
分解后得到的![]() ,所以得先加碱把
,所以得先加碱把![]() 除掉,反应为:
除掉,反应为:![]() ,然后过滤洗涤灼烧即可;
,然后过滤洗涤灼烧即可;
![]() 从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到
从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到![]() ,可以循环使用的物质是
,可以循环使用的物质是![]() ;
;
![]() 同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大,即产品中镁的质量就大。
同质量的碳酸镁和碱式碳酸镁中镁的物质的量前者大,即产品中镁的质量就大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A. 加入少量NaOH固体,c(CH3COO-)减小
B. 加入少量FeCl3固体,c(CH3COO-)减小
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(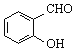 )和对羟基苯甲醛(
)和对羟基苯甲醛(![]() )的沸点
)的沸点
D. C-O和Si-O的键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
(1)连续自动监测氮氧化物![]() 的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______。
的仪器--动态库仑仪已获得实际应用.它的工作原理如下图所示,NiO电极上NO发生的电极反应式为 ______。
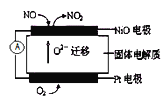
(2)使用稀土催化剂有效消除汽车尾气中的![]() 、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将
、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将![]() 、
、![]() 转化成无毒物质,相关反应为:
转化成无毒物质,相关反应为:
①![]()
②![]()
③![]()
则![]() ______(用
______(用![]() 和
和![]() 表示)。
表示)。
(3)实验室在恒压下,将![]() 和
和![]() 置于密闭容器中发生反应③,测得在不同温度、不同投料比时,
置于密闭容器中发生反应③,测得在不同温度、不同投料比时,![]() 的平衡转化率如下表:
的平衡转化率如下表:
投料比 | 400K | 500K | 600K |
1 |
|
|
|
2 |
|
|
|
①在![]() 与
与![]() 反应时,可提高
反应时,可提高![]() 转化率的措施有 ______填编号
转化率的措施有 ______填编号![]() 。
。
A 增加催化剂的表面积 ![]() 改用高效催化剂
改用高效催化剂 ![]() 降低温度
降低温度
D 增大压强 ![]() 分离出
分离出![]()
![]() 减小
减小![]()
②![]() 时,将投料比为1的
时,将投料比为1的![]() 和
和![]() 的混合气体共
的混合气体共![]() ,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______。(写出计算过程,计算结果保留三位有效数字)
,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数______。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出![]() 内,容器中
内,容器中![]() 物质的量浓度c随时间变化的曲线图______。
物质的量浓度c随时间变化的曲线图______。
(4)SNCR是一种新型的烟气脱氮环保技术,在有氧条件下,其脱氮原理是:![]() 和
和![]() 在
在![]() 催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是
催化剂表面的反应随温度的变化曲线如图所示,图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是![]() 回答两条
回答两条![]() : ______。
: ______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.常温下,反应![]() 能自发进行,则该反应的
能自发进行,则该反应的![]()
B.浑浊的苯酚试液中加入饱和![]() 溶液变澄清,则酸性:苯酚
溶液变澄清,则酸性:苯酚![]() 碳酸
碳酸
C.铅蓄电池在放电过程中,负极质量减少,正极质量增加
D.用饱和![]() 溶液处理
溶液处理![]() 沉淀,可将
沉淀,可将![]() 转化为
转化为![]() ,说明
,说明![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或推理正确的是
A. 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质
B. 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9
C. 25℃时,Ksp(BaCO3)>Ksp(BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好
D. 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )
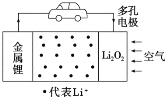
A.电解液中,Li+由多孔电极迁移向锂电极
B.该电池放电时,负极发生了还原反应
C.充电时,电池正极的反应式为Li2O2-2e-=2Li++O2↑
D.电池中的电解液可以是有机电解液或稀盐酸等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com