
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是

A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
【答案】C
【解析】随PH增大,C(H2A)减小、C(HAˉ)先增后减、C(A2-)增大;根据图示,曲线Ⅰ表示c(HAˉ)、曲线Ⅱ表示C(H2A)、曲线Ⅲ表示c(A2-);根据图示,pH=4时,c(HAˉ)>c(A2-),故A错误;调节溶液PH的方法不确定,所以c(H2A)+c(HAˉ)+c(A2-)不一定是定值,故B错误;根据图示C(H2A)= C(HAˉ)时,PH=1.3,所以Ka1=![]() = 10-1.3,故C正确;根据图示c(A2-)= C(HAˉ)时,PH=4.3,Ka2=
= 10-1.3,故C正确;根据图示c(A2-)= C(HAˉ)时,PH=4.3,Ka2=![]() ,HAˉ的水解常数=
,HAˉ的水解常数=![]() ,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
电解:酸式弱酸盐NaHA溶液酸碱性的判断方法:若HAˉ的电离平衡常数大于HAˉ的水解平衡常数,溶液呈酸性;若HAˉ的电离平衡常数小于HAˉ的水解平衡常数,溶液呈碱性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体,在一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示。图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段使用了催化剂;图甲中t0~t1阶段c(B)的变化情况未画出。
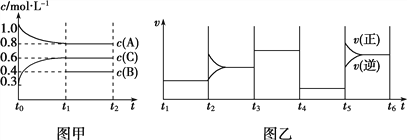
下列说法不正确的是( )
A. 该反应为吸热反应 B. B在t0~t1阶段的转化率为60%
C. t4~t5阶段改变的条件为减小压强 D. t1时该反应的化学平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(![]() ) = c(Na+)
) = c(Na+)
B. NH3·H2O的电离方程式:NH3H2O ===![]() + OH-
+ OH-
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:
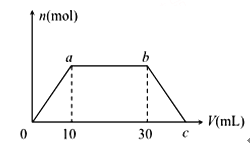
(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A. 分散质粒子直径与分散系种类:![]()
B. NaOH溶液与CO2反应后溶液中的钠盐:
C. AlCl3溶液中滴加NaOH溶液后铝的存在形式:![]()
D. Na与O2反应的产物:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com