
| ʱ��t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
| ��c |
| ��t |
| c2(B)?c(C) |
| c(A) |
| c2(B)?c(C) |
| c(A) |
| 0.1 |
| 0.1-x+2x+x |
| 1 |
| 1.8 |
| ��c |
| ��t |
| ||
| 2min |
| 0.24mol |
| 0.1mol |
| 0.14mol |
| 2.4L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �Լ�Z | ����X | ����Y | |
| A | NH3��H2O | Al3+ | Mg2+ |
| B | AgNO3 | Cl- | CO32- |
| C | Na2SO4 | Ba2+ | Mg2+ |
| D | Ba��NO3��2 | SO42- | CO32- |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����CH3CH2OH����CH3COOH���ݾ���ϩ���������У�
����CH3CH2OH����CH3COOH���ݾ���ϩ���������У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| A����Ϊ������H2SO4Ϊ���Һ |
| B����Ϊ������ŨNaOHΪ���Һ |
| C�����������ĵ缫��ӦΪFe+8OH--6e-�T4H2O+FeO42- |
| D����ʧȥ3 mol���ӿ����������õ�33.6 L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1mol/LHNO3��Һ |
| B��ˮ���������C��H+��=10-9mol/L������ |
| C��pHΪ6������ |
| D��1��10-3mol/L NaCl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ͭ����Ʒ�Ʋ����������Ʒ������ǰ���������� |
| B����֪AgCl��Ksp=1.8��10-10��Ag2CrO4��Ksp=1.2��10-12��������ͬ�¶���AgCl���ܽ�ȴ���Ag2CrO4 |
| C�������£���pH=8�Ĵ�������Һϡ�ͣ���Һ����������Ũ�ȶ���С |
| D����Ӧ3NO2��g��+H2O��l��=2HNO3��aq��+NO��g���������¿��Է����У���÷�Ӧ�ġ�H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
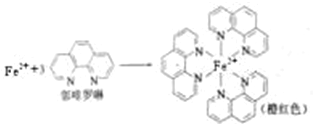
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������Ե��� |
| B�������ǻ���� |
| C���������Ӵ�С��1��100nm֮�� |
| D����ɢ��Ϊ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com