
| A. | 金属钠暴露在空气中,表面变暗,生成白色的氧化钠固体 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量的热,产生白色粉末 | |
| C. | 用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 | |
| D. | 用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
分析 A.常温下钠表面生成白色固体氧化钠;
B.根据镁在空气燃烧的现象分析;
C.铝箔在空气中不能燃烧;
D.给铝箔在酒精灯上加热时,铝熔化,而形成的氧化铝薄膜熔点高未熔化,包裹着的内层熔化的铝而不会滴落.
解答 解:A.氧化钠是白色固体,故A正确;
B.坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色氧化镁固体,故B正确;
C.铝箔在空气中不能燃烧,故C错误;
D.用坩埚钳夹住一小块铝箔,由于铝熔点低,所以在酒精灯上加热铝熔化,失去了光泽,由于氧化铝熔点较高,加热时氧化膜包裹着的内层熔化的铝而不会滴落,故D错误;
故选AB.
点评 本题综合考查元素化合物知识,涉及铝、钠以及镁的性质,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
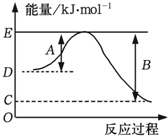 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
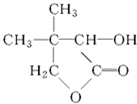 G的合成路线如图:
G的合成路线如图: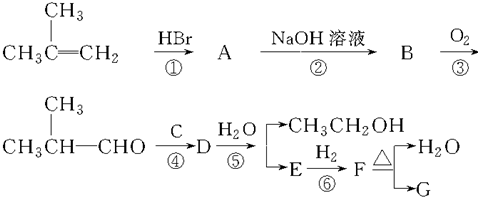
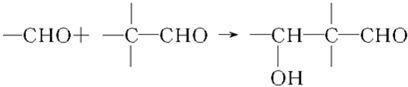
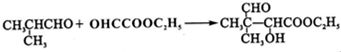
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 | |
| B. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| C. | 二氧化碳通入水玻璃可以得到硅酸 | |
| D. | 因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com