
| A. | 金属表面的氧化膜都很致密,能对金属起到保护作用 | |
| B. | 金属表面的氧化膜的形成都需要金属暴露在空气中很长时间才会形成 | |
| C. | 金属表面的氧化膜薄层的厚度会随着金属暴露在空气中的时间增长而加厚 | |
| D. | 某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用 |
分析 金属被空气中的氧气氧化,表面形成一层氧化物薄膜,这些氧化膜有的疏松,不能保护内层金属;有的致密,可以保护内层金属.致密金属氧化膜会保护内部金属不被氧化,所以厚度一般不会随时间的增长而加厚,以此来解答.
解答 解:A.金属被空气中的氧气氧化,表面形成一层氧化物薄膜,这些氧化膜有的疏松,不能保护内层金属,故A错误;
B.金属表面的氧化膜的形成不一定需要金属暴露在空气中很长时间才会形成,如活泼金属易被氧化,故B错误;
C.致密金属氧化膜会保护内部金属不被氧化,所以厚度一般不会随时间的增长而加厚,故C错误;
D.某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用,如Al表面的氧化膜为致密结构可阻止内部金属被氧化,故D正确;
故选D.
点评 本题考查金属氧化膜及金属腐蚀,为高频考点,把握物质的性质及应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
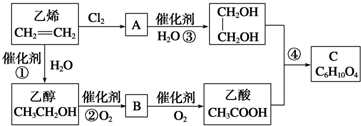
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
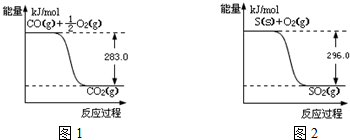
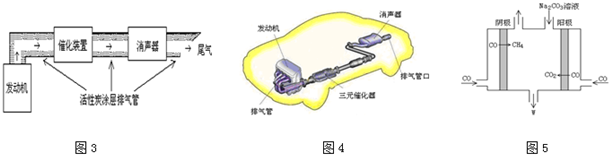
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 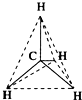 结构示意图 | B. |  电子式 | C. | 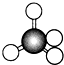 球棍模型 | D. | 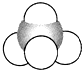 比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 由水电离的c (H+)=1×10-14 mol?L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
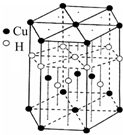 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: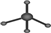 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: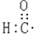 | D. | 甲醛的结构式: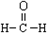 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com