
| 1 |
| 100 |
| 1 |
| 100 |


科目:高中化学 来源: 题型:
| A、Al3+、Na+、SO42-、Cl- |
| B、Na+、Cu2+、SO42-、NO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
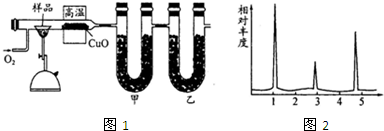
| 实验前 | 实验后 |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:
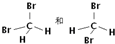 ;⑦葡萄糖和果糖; ⑧金刚石与石墨.
;⑦葡萄糖和果糖; ⑧金刚石与石墨.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | v (正)和v (逆)比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v (正)=v (逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v (正) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com