
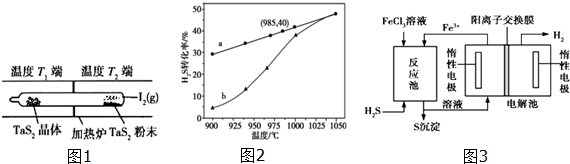
分析 (1)在高温时,将金红石(TiO2)、炭粉混合并通人Cl2先制得TiCl4和一种可燃性气体,是金红石(TiO2)、炭粉混和通人Cl2发生反应生成TiCl4和一种可燃性气体为CO,利用盖斯定律,将热化学方程式进行运算得到所需热化学方程式;
(2)K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,平衡常数计算式可知平衡浓度可以利用物质的量代替直接计算平衡常数,所以带入K值可以得出转化率x;
通过题意可知温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)①由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快;
②电解池中亚铁离子失去电子,氢离子得到电子,反应生成铁离子和氢气,以此来解答.
解答 解:(1)①TiO2 (s)+2Cl2(g)═TiCl4(1)+O2(g);△H=-410.0kJ•mol-1
②CO(g)═C(s)+$\frac{1}{2}$O2(g);△H=+110.5kJ•mol-1
依据盖斯定律内容用上述热化学方程式计算,①-②×2得到则上述反应的热化学方程式是:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;高温\;}}{\;}$TiCl4(l)+2CO(g)△H=-631kJ/mol,
故答案为:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;高温\;}}{\;}$TiCl4(l)+2CO(g)△H=-631kJ/mol;
(2)K=1,设 I2的平衡转化率为x,则参加反应的I2为xmol,
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H1>0
起始量(mol) 1 0 0
变化量(mol) x 0.5x 0.5x
平衡量(mol) 1-x 0.5x 0.5x
平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,体积为15ml,结合平衡常数计算式可知,平衡浓度可以用物质的量代替来计算平衡常数,则根据K=$\frac{[Ta{I}_{4}][{S}_{2}]}{[{I}_{2}]^{2}}$=$\frac{0.5x×0.5x}{(1-x)^{2}}$=1,
解之得:x=66.7%,
由所给方程式可知该反应为吸热反应,通过题意可知温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,其中I2是可以循环使用的物质,
故答案为:66.7%;<;I2;
(3)①以H2S起始浓度均为cmol•L-1测定H2S的转化率,由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需的进间缩短;
②电解池中亚铁离子失去电子生成铁离子,氢离子得到电子生成氢气,电解总反应的离子方程式为2Fe2++2H+ $\frac{\underline{\;通电\;}}{\;}$2Fe3++H2↑,
故答案为:2Fe2++2H+ $\frac{\underline{\;通电\;}}{\;}$2Fe3++H2↑.
点评 本题主要考查了盖斯定律及其以硫化氢为载体考查物质的性质、影响反应速率的因素、化学平衡、电化学等,题目综合性强,难度较大,注重了高考常考考点的考查,注意知识的迁移应用和信息的处理.


科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 9种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | Na2O2中阴、阳离子的个数比为1:1 | |
| C. | Na2O2与CO2反应,每消耗1mol Na2O2,转移电子的物质的量为1mol | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂只有锂 | |
| B. | SOCl2中每个原子都达到8电子稳定结构 | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | 生成1.12 LSO2时,反应转移电子为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 | |
| B. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故 | |
| C. | 硫酸、纯碱、小苏打和二氧化硫分别属于酸、碱、盐和酸性氧化物 | |
| D. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液能用于腐蚀铜线路板 | B. | 用小苏打治疗胃酸过多 | ||
| C. | 过氧化钠作供氧剂 | D. | 用还原性铁粉作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com