
|
0.1 mol/L的CH3COOH溶液中CH3COOH | |
| [ ] | |
A. |
加水时,平衡向逆反应方向移动 |
B. |
加入通入HCl气体,平衡逆向移动,溶液中c(H+)减小 |
C. |
加入少量NaOH固体,平衡向正反应方向移动 |
D. |
加入少量CH3COONa固体,平衡向正反应方向移动 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:湖北省武汉市部分学校2007-2008高三起点调研测试化学试卷 题型:013
|
用NA表示阿伏加德罗常数,下列叙述中正确的是 | |
| [ ] | |
A. |
0.1 mol/L稀硫酸100 mL中含有硫酸根离子个数为0.1 NA |
B. |
1 mol CH |
C. |
2.4 g金属镁与足量的盐酸反应,转移的电子数为0.2 NA |
D. |
1 L 1 mol/L的盐酸溶液中,所含氯化氢分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.0.1 mol·L-1稀硫酸100 mL中含有硫酸根个数为0.1NA
B.1 mol CH+3(碳正离子)中含有电子数为10NA
C.2.4 g金属镁与足量的盐酸反应,转移电子数为2NA
D.12.4 g白磷中含有磷原子数为0.4 NA
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(带解析) 题型:单选题
25 ℃ 时,下列各溶液中关系的叙述中,正确的是( )
| A.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-) =" 0.1" mol/L,则BA(盐)溶液pH<7 |
| B.pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2∶1 |
| C.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c(Na+) + c(H+)=c(OH-) + c(CH3COO-) |
| D.4种pH相同的溶液①CH3COONa ②NaClO ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 615.3 | 414.4 | 347.4 | 435.3 |
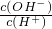 =10-14的溶液中:Al3+、NH4+、Cl-、CO32-能大量存在
=10-14的溶液中:Al3+、NH4+、Cl-、CO32-能大量存在查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com