
ijͬѧģ�ҵ���۵���ȷ�������������ˮ��ԭ�������������о���
| װ�ã����������ã��Լ������ӣ� | ���� | ���� |
|
| ��Һ©����������μ���Ũ��ˮ | ����C��������ɫ��dz �����Ժ�C�г��ְ��̲������� |
��1��Ũ��ˮ�ֽ�����ư�����д��A�з�Ӧ�Ļ�ѧ����ʽ�� ����ƽ���ƶ� �ĽǶȷ���NaOH�����ڰ�ˮ�ֽ��е����� ��
��2������C�з����ķ�ӦΪ��2NH3(g)��3Cl2(g)�� N2(g)��6HCl(g) H= ��456 kJ��mol-1
��֪��
��NH3�ĵ���ʽ�� ��
�ڶϿ�1mol H��N����Ͽ�1molH��Cl�������������ԼΪ ��
��3�������в������̵Ļ�ѧ����ʽ�� ��
��4��Ϊ�������ɰ��̣���ѧ���������ͼװ�������Cl2��NH3�ķ�Ӧ��
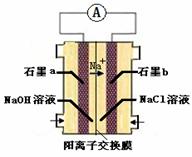
����װ����ʵ�����Ŀ�꣬���ʯīb�缫�Ϸ������� ��Ӧ�����������ԭ����
��д��ʯīa�缫�ĵ缫��Ӧʽ�� ��
���𰸡�
��1��NH3��H2O NH3��+H2O ��ˮ�ֽ�������ȣ�NaOH��������ˮ���ȣ�ʹ�����¶����ߣ���ˮ�ֽⷴӦƽ�������ƶ����ٽ��˰�ˮ�ֽ⡣����NaOH��������ˮ�ԣ������հ�ˮ�ֽ����ɵ�ˮ���ٽ���ˮ�ֽ�ƽ�������ƶ���
NH3��+H2O ��ˮ�ֽ�������ȣ�NaOH��������ˮ���ȣ�ʹ�����¶����ߣ���ˮ�ֽⷴӦƽ�������ƶ����ٽ��˰�ˮ�ֽ⡣����NaOH��������ˮ�ԣ������հ�ˮ�ֽ����ɵ�ˮ���ٽ���ˮ�ֽ�ƽ�������ƶ���
��2���� �� 40 ��3�� HCl+NH3=NH4Cl
�� 40 ��3�� HCl+NH3=NH4Cl
��4���ٻ�ԭ ���� 2NH3��6OH-��6e-��N2��6H2O
��������
�����������1��Ũ��ˮ���ȷֽ�����ư����� A�з�Ӧ�Ļ�ѧ����ʽ��NH3��H2O NH3��+H2O����ˮ�ֽ�������ȣ�NaOH��������ˮ���ȣ�ʹ�����¶����ߣ���ˮ�ֽⷴӦƽ�������ƶ����ٽ��˰�ˮ�ֽ⡣��2����NH3�ĵ���ʽ��
NH3��+H2O����ˮ�ֽ�������ȣ�NaOH��������ˮ���ȣ�ʹ�����¶����ߣ���ˮ�ֽⷴӦƽ�������ƶ����ٽ��˰�ˮ�ֽ⡣��2����NH3�ĵ���ʽ�� ����6��N��H+3��243KJ -945KJ -6��H��Cl=��456 kJ�����N��H��Cl��H�ļ��ܵIJ���40KJ/mol���Ͽ�1mol H��N����Ͽ�1molH��Cl�������������ԼΪ40KJ/mol����3�������в�������NH4Cl�Ļ�ѧ����ʽ��HCl+NH3=NH4Cl����4������ͼʾ��֪Na+��b�缫�����ƶ�������ͬ�ֵ����ų⣬���ֵ���������ԭ��ʯīb�缫���������������Ϸ������ǻ�ԭ��Ӧ����ʯīa�缫���������������Ϸ�Ӧ������Ӧ���õ缫�ĵ缫��Ӧʽ��2NH3��6OH-��6e-��N2��6H2O��
����6��N��H+3��243KJ -945KJ -6��H��Cl=��456 kJ�����N��H��Cl��H�ļ��ܵIJ���40KJ/mol���Ͽ�1mol H��N����Ͽ�1molH��Cl�������������ԼΪ40KJ/mol����3�������в�������NH4Cl�Ļ�ѧ����ʽ��HCl+NH3=NH4Cl����4������ͼʾ��֪Na+��b�缫�����ƶ�������ͬ�ֵ����ų⣬���ֵ���������ԭ��ʯīb�缫���������������Ϸ������ǻ�ԭ��Ӧ����ʯīa�缫���������������Ϸ�Ӧ������Ӧ���õ缫�ĵ缫��Ӧʽ��2NH3��6OH-��6e-��N2��6H2O��
���㣺���鰱������ȡ���������ʵĵ���ʽ�����ܴ�С�ıȽϡ���ѧ����ʽ���缫��Ӧʽ����д��֪ʶ��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����豸����ʱ,����ѧ��ת��Ϊ���ܵ���(����)
| A | B | C | D |
|
|
|
|
|
| ��̫���ܵ�� | ����ӵ�� | ̫���ܼ����� | ȼ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Դת�������У���Ⱦ�ϴ����
A�� ���ܷ��� B�� ȼú���� C�� �����ܷ��� D�� ̫���ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ��ˮ�д��ڵ���ƽ�⣺

 ������������ȷ����
������������ȷ����
A����ˮ���ȣ� ����
���� ����
����
B����ˮ�м�������NaHSO4���壬c(H+)���� ����
����
C����ˮ�м������� ���壬ƽ�������ƶ���
���壬ƽ�������ƶ��� ����
����
D����ˮ�м������� ���壬ƽ�������ƶ���
���壬ƽ�������ƶ��� ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н���ʵ��Ӧ�õ�ԭ������ʽ�У�����ȷ����
A�� ���ű���ʳ��ˮ���ռ� ��
��


B�� �ȵĴ�����Һ������ǿ��


C�� �� ����Һ�м���
����Һ�м��� ��Һ��
��Һ��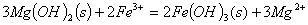
D�� ����FeCl3��ҺʱΪ��ֹ��Һ���dz���������ϡ����Fe3++3H2O Fe(OH)3+3H+,
Fe(OH)3+3H+,
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ͨ�뵽������Һ����Һ����ɫ��˵�������Ư���Ե��ǣ� ��
A�����Ը��������Һ������ B����ˮ
C�����з�̪��NaOH��Һ��������D��Ʒ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ŨH2SO4��ϡH2SO4���ȼ��ֿɿ��ķ����� �� ��
A.��ȡ������Һ�ֱ����ͭƬ` B.�ֱ���ʯ����Һ����
C.�ò�������պ����ҺͿ��ֽ�� D.��ȡ������Һ�ֱ������Ƭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
50mL 18mol/L�������м���������ͭƬ�����ȣ�����ԭ����������ʵ��������� ��
A����0.45mo1���������������� B������0.45mol
C����0.45mol��0.9mol֮�䡡����D������0.9mo1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪299 Kʱ���ϳɰ���Ӧ N2 (g ) + 3H2 ( g )��2NH3 ( g ) ��H = -92.0 kJ/mol�������¶��µ�1 mol N2 ��3 mol H2 ����һ�ܱ������У��ڴ�������ʱ���з�Ӧ���ﵽƽ��ʱ����Ӧ�ų�������Ϊ������������ʧ������������
A��һ������92.0 kJ B��һ������92.0 kJ
C������ȷ�� D�� һ��С��92.0 kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com