
【题目】常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
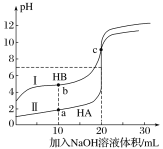
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
【答案】A
【解析】
A、中和反应是放热反应,温度越高水的离子积常数越大,即水电离的c(H+)·c(OH-)变大,故A错误;
B、由图可知,0.1mol·L-1HA的溶液的pH=1,说明HA为强酸,而0.1mol·L-1HB的溶液的pH>1,说明HB为弱酸,HB的酸性比HA的酸性弱,即HB的电离程度小于HA的电离程度,所以B选项是正确的;
C. V=10mL时,一半的酸被中和,所以所得溶液为等物质的量浓度的HB和NaB,存在物料守恒得:c(HB)+c(B-)=2c(Na+),所以C选项是正确的;
D. V=20mL时,酸碱恰好完全反应,得到等物质的量浓度的NaA和NaB溶液,由于B-离子会发生水解,则有c(A-)>c(B-),所以D选项是正确的。
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2![]() 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
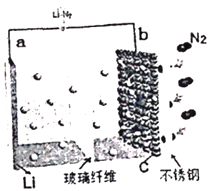
A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行物质制备时,下列从原料及有关试剂分解制取相应的最终产物的设计中,理论上有错误或操作上不可行或经济上不合理的是( )
A. FeFe2O3 ![]() Fe2(SO4)3溶液
Fe2(SO4)3溶液
B. C![]() CO
CO![]() CO2
CO2![]() Na2CO3溶液
Na2CO3溶液
C. CuO![]() CuSO4溶液
CuSO4溶液![]() Cu
Cu
D. CaO![]() Ca(OH)2溶液
Ca(OH)2溶液![]() NaOH溶液
NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H的含义表示正确的是
A. H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H(中和热)
B. NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l) △H(中和热)
Na2SO4(aq)+H2O(l) △H(中和热)
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H(燃烧热)
D. 2H2(g)+O2(g)=2H2O(g) △H(燃烧热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
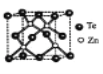
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
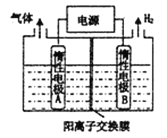
A. B极区电解液为LiOH溶液
B. 每产生2.24L氢气,就有0.2 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOX可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=﹣1 160 kJmol﹣1。
已知NO、NO2混合气体的密度是相同条件下氢气密度的17倍,16 g甲烷和该混合气完全反应生成N2、CO2、H2O(g)放出1 042.8 kJ的热量,则ΔH1是( )
A. ﹣867 kJmol﹣1 B. ﹣574 kJmol﹣1 C. ﹣691.2 kJmol﹣1 D. ﹣925.6 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的_________。
A.用石斧解剖 B.早期的农业耕作
B.早期的农业耕作
C.简单机械织布![]() D.祥云火炬燃烧
D.祥云火炬燃烧![]()
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
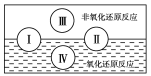
试写出一个有水生成的属于类型Ⅲ的化学方程式_________;
有水参加的反应:C+H2O(g)![]() CO+H2,符合图中反应类型______(填标号)。
CO+H2,符合图中反应类型______(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。

(1)若以A点表示25 ℃时水在电离平衡时的离子浓度,当温度升到100 ℃时,水的电离平衡状态到B点,则100 ℃时,水的离子积为______________。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100 ℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为_______________________。
(3)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________________,由水电离出的c(OH-)=_______________mol·L-1。
(4)等体积的下列溶液中,阴离子的总物质的量最大的是_____________(填序号)。
①0.1 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.1 mol·L-1的KCl ④0.1 mol·L-1的NaHCO3
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-,HA-H++A2-。
①则Na2A溶液显__________(填“酸性”“中性”或“碱性”);NaHA溶液显__________(填“酸性”“中性”或“碱性”)。
②现有0.1 mol·L-1 Na2A的溶液,其中各种微粒浓度关系正确的是__________(填字母)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)
B.c(Na+)=2c(HA-)+2c((A2-)+2c(H2A)
C.c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)
D.c(OH-)=c(HA-)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com