
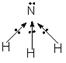
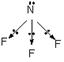
(15分)在铜的催化作用下氨和氟反应得到一种铵盐和一种三角锥体分子A(键角102o,偶极矩0.78x10-30 C?m;对比:氨的键角107.3o,偶极矩4.74x10-30 C?m);
4-1 写出A的分子式和它的合成反应的化学方程式。
4-2 A分子质子化放出的热明显小于氨分子质子化放出的热。为什么?
4-3 A与汞共热,得到一种汞盐和一对互为异构体的B和C(相对分子质量66)。写出化学方程式及B和C的立体结构。4-4 B与四氟化锡反应首先得到平面构型的D和负二价单中心阴离子E构成的离子化合物;这种离子化合物受热放出C,同时得到D和负一价单中心阴离子F构成的离子化合物。画出D、E、F的立体结构;写出得到它们的化学方程式。
4-5 A与F2、BF3反应得到一种四氟硼酸盐,它的阳离子水解能定量地生成A和HF,而同时得到的O2和H2O2的量却因反应条件不同而不同。写出这个阳离子的化学式和它的合成反应的化学方程式,并用化学方程式和必要的推断对它的水解反应产物作出解释。4-1 NF3 (1分) 4NH3 + 3F2 = NF3 + 3NH4F(1分) (共2分)
4-2 N-F 键的偶极方向与氮原子孤对电子的偶极方向相反,导致分子偶极矩很小,因此质子化能力远比氨质子化能力小。 画图说明也可,如:
 (1分)
(1分)
4-3 2NF3 +2Hg = N2F2 + 2HgF2 (1分)
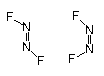 (14+19)X2=66 (每式1分) (共3分)
(14+19)X2=66 (每式1分) (共3分)
4-4: 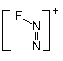 D
D  E
E 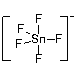 F (每式1分)
F (每式1分)
2 N2F2 + SnF4 = [N2F+]2[SnF6]2- (1分)
[N2F+]2[SnF6]2- = [N2F] +[SnF5]- + N2F2 (1分) (共5分)
4-5 阳离子的化学式为NF4+。(1分)
NF3 + F2 + BF3 = NF4+BF4- (1分)
NF4+水解反应首先得到HOF (否则写不出配平的NF4+水解反应):
NF4++H2O = NF3+HOF+H+ 定量生成NF3。(1分)
而反应2HOF = 2HF+O2和反应HOF+H2O = HF+H2O2 哪一反应为主与反应条件有关,但无论哪一反应为主却总是定量生成HF。(1分) (共4分)


科目:高中化学 来源: 题型:
 (2012?南京模拟)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到.
(2012?南京模拟)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到.查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市高三上学期期中考试化学试卷 题型:填空题
(16分)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)该反应的化学方程式为 ▲ ,每生成1molNF3,转移的电子数为 ▲ ,生成物NF3中氮原子的杂化方式为 ▲ ,NF3分子空间构型为 ▲ ;
(2)N、F两种元素的氢化物稳定性比较,NH3 ▲ HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式 ▲ ;
(4) 氯化铜溶液中加入过量氨水,可以生成四氨合铜络离子, 写出该反应的化学方程式 ▲ ;
(5)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如左图,该离子化合物的化学式为 ▲ 。
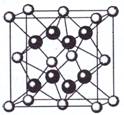
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三10月份月考化学试卷 题型:填空题
(16分)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)该反应的化学方程式为 ,每生成1molNF3,转移的电子数为
生成物NF3中氮原子的杂化方式为 ,NF3分子空间构型为 ;
(2)N、F两种元素的氢化物稳定性比较,NH3 HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式 ;
(4)氯化铜溶液中加入过量氨水,可以生成四氨合铜络离子, 写出该反应的化学方程式 ;
(5)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如左图,该离子化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如右图所示。
①合成氨条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学反应速率及化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
②改变反应条件,平衡会发生移动。压强增大,平衡常数K (填“增大”“减小”“不变”)
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1 mol B,转移电子的数目为 。
(3) 最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com