
分析 平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
a.正反应是吸热反应,温度越高,K越大,生成物浓度越大,反应物浓度越小,即c(CO)/c(CO2)增大;
b.反应前后气体体积不变,增大压强化学平衡不移动,即c(CO)/c(CO2)不变;
c.充入一定量CO,温度不变,化学平衡常数不变,则c(CO)/c(CO2)不变;
d.化学平衡中,纯固体纯液体不影响化学反应速率,即加入铁粉,化学平衡常数不变.
解答 解:平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,由于Fe和FeO为固体,不能写在化学平衡常数表达式中,所以K=$\frac{c(CO)}{c(C{O}_{2})}$,
故答案为:$\frac{c(CO)}{c(C{O}_{2})}$;
a.正反应是吸热反应,温度越高,K越大,生成物浓度越大,反应物浓度越小,即c(CO)/c(CO2)增大,故a正确;
b.反应前后气体体积不变,增大压强化学平衡不移动,即c(CO)/c(CO2)不变,故b错误;
c.充入一定量CO,温度不变,化学平衡常数不变,则c(CO)/c(CO2)不变,故c错误;
d.化学平衡中,纯固体纯液体不影响化学反应速率,即加入铁粉,化学平衡常数不变,故d错误;
故选a.
点评 本题考查化学平衡常数表达式,难度不大,注意纯固体纯液体不能写在化学平衡常数表达式中.


科目:高中化学 来源: 题型:选择题
| A. | 15 g甲基所含有的电子数是NA | |
| B. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA | |
| D. | 常温常压下,1 mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
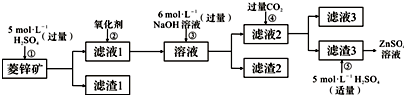
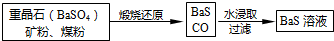
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
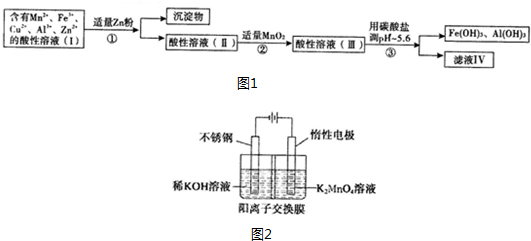
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢不稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 得电子能力强于硫 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由大到小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com