
| A. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| C. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| D. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 |
分析 A.酯化反应以及酯类的水解都为取代反应;
B.卤代烃水解为取代反应,烯烃与水发生加成反应;
C.甲苯分别发生取代、氧化反应;
D.氯代环己烷消去制环己烯发生消去反应;由丙烯加溴制1,2二溴丙烷发生加成反应.
解答 解:A.由乙酸和乙醇制乙酸乙酯发生酯化反应,也为取代反应;由苯甲酸乙酯水解制苯甲酸和乙醇,为酯类的水解,也为取代反应,故A正确;
B.由溴丙烷水解制丙醇为取代反应,由丙烯与水反应制丙醇发生加成反应,故B错误;
C.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸,分别发生取代、氧化反应,故C错误;
D.氯代环己烷消去制环己烯发生消去反应;由丙烯加溴制1,2二溴丙烷发生加成反应,反应类型不同,故D错误.
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团及官能团与性质的关系为解答的关键,侧重性质及有机反应类型的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 质子数和中子数均为6的碳原子${\;}_{6}^{6}$C | |
| B. | 溴化铵的电子式: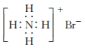 | |
| C. | 氢氧化钠的电子式: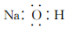 | |
| D. | 2-丙醇的结构简式: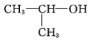 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
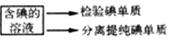
| A. | 在灼烧过程中使用的玻璃仪器有酒精灯、玻璃棒、坩埚 | |
| B. | 在上述氧化过程中发生反应的离子方程式为2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④⑥⑦ | C. | ①②⑥⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

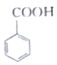 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$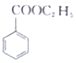 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.80 | 23.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com