
| A、0.1mol?L-1Mg(NO3)2溶液中含有0.2nA个NO3- |
| B、8g CH4中含有10nA个电子 |
| C、常温常压下,22.4L O3中含有3nA个氧原子 |
| D、28g C2H4中含有2nA个碳原子 |
| m |
| M |
| m |
| M |
| m |
| M |
| 8g |
| 16g/mol |
| m |
| M |
| 28g |
| 28g/mol |


科目:高中化学 来源: 题型:
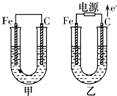 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
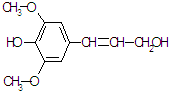 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关说法正确的是( )| A、芥子醇的分子式是C11H16O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、芥子醇能与3mol溴水反应 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V |  |  | 见① |
| 2 | V | 0.50 | 30.8 | 30.30 |
| 3 | V | 6.00 | 36.35 | 30.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
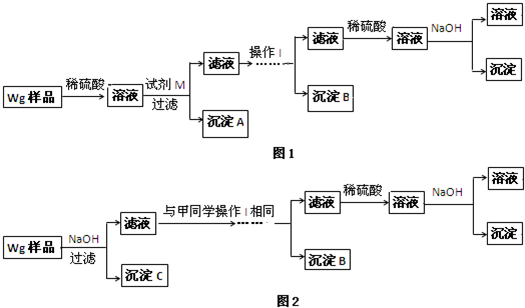
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com