
| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
分析 1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ.恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(N2):n(H2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的n(N2)是①中的2倍,据此判断.
解答 解:1molN2(g)与3molH2(g)反应生成2molNH3(g)放出的热量是92.4kJ,反应为可逆反应,物质不能完全反应,恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(N2):n(H2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的n(N2)是①中的2倍,所以Q2=2 Q1<184.8 kJ.
故选A.
点评 考查热化学方程式的意义、反应热的计算、可逆反应特征、等效平衡等,难度中等,注意掌握等效平衡规律、理解热化学方程式意义.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的转化率变大 | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数变大 | D. | a>c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 第IA族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 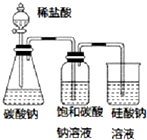 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 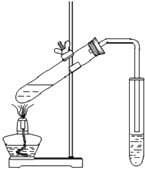 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 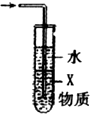 图中X若为CCl4,可用于吸收NH3或HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com