
已知:①NaNO2具有强氧化性
②
奥沙拉秦是一种抗菌药。其合成路线如下:

(1)写出下列反应的化学方程式:
水杨酸→A_________________________________________________________;
A→B __________________________________________________;
(2)写出D的结构简式______________________;
(3)写出下列反应的反应类型:D→E______________,F→奥沙拉秦___________;
(4)从整个合成路线看,设计B→C步骤的作用是___________________________;
(5)F的结构简式为___________________;
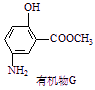 (6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是
(6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是![]() -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:模拟题 题型:填空题
 N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。
N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com