
| A、先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则待测液中一定含有钾元素 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、450 mL,52.7 g |
| B、500 mL,58.5 g |
| C、1000 mL,117 g |
| D、任意规格,111.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低 |
| B、由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高 |
| C、合成氨工业的反应温度控制在500℃,目的是使化学平衡向正反应方向移动 |
| D、合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B、原混合物一定含有Na+、Al3+、NO2- |
| C、白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D、气体乙一定是NO和NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 10 |
| 加热温度/℃ | 25 | 70 | 80 | 100 | 130 | 250 | 300 | 350 | 400 | 450 |
| 固体质量/g | 42.2 | 42.2 | 40.1 | 36.8 | 36.8 | 36.8 | 36.8 | 36.8 | 32.0 | 32.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
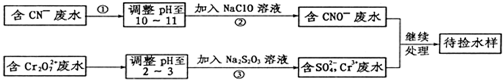
查看答案和解析>>
科目:高中化学 来源: 题型:
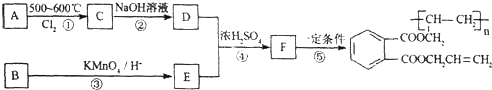

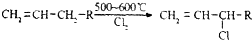
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com