
分析 依据化学方程式和平衡常数概念书写表达式,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积得到;据平衡浓度和平衡常数计算式列式计算得到K的数值;K只受温度的影响,升高温度,平衡向着吸热方向移动,降温,向着放热方向进行;增大压强,化学平衡常数无影响.
解答 解:(1)A(g)+3B(g)═2C(g)在一定温度下达到平衡,反应的平衡常数K=$\frac{{c}^{2}(C)}{c(A)•{c}^{3}(B)}$;若各物质的平衡浓度分别为c(A)=2.0mol/L、c(B)=2.0mol/L、c(C)=1.0mol/L,则平衡常数K=$\frac{{c}^{2}(C)}{c(A)•{c}^{3}(B)}$=$\frac{1.{0}^{3}}{2.0×2.{0}^{3}}$=0.125,若升高温度化学平衡常数K减小,则反应是放热的,如果增大压强,化学平衡常数K不变,故答案为:$\frac{{c}^{2}(C)}{c(A)•{c}^{3}(B)}$;0.125;放热反应;不变.
点评 本题考查了化学平衡影响因素分析,平衡常数的计算,掌握平衡移动原理和实质是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | [H+]=10-12mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | $\frac{O{H}^{-}}{{H}^{+}}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL1mol/L的FeC13溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4NA | |
| C. | 标准状况下,44.8LHF所含分子数为2NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否有丁达尔现象 | B. | 是否均一、透明、稳定 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
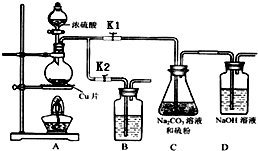 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com