
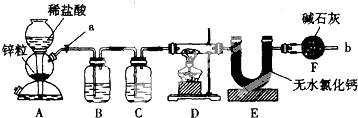
分析 (1)氢气是可燃性气体,为了安全,在点燃D处的酒精灯之前,在b出口处必须检验氢气的纯度;
(2)A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验;
(3)D装置发生的反应是氢气还原氧化亚铁、氧化铁的反应,生成了铁和水;
(4)根据氧化铁、氧化亚铁的总质量及U型管的质量增加7.2g为水的质量列式计算;
(5)若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,氧元素物质的量偏大,Fe2O3的质量也将偏大;
(6)若反应后得到的残留固体中还有少量FeO,则测得的Fe2O3质量将导致生成水的质量减小,导致氧的含量减小,Fe2O3的质量将减小.
解答 解:(1)氢气是可燃性气体,装置中需要充满氢气后方可进行加热反应,所以需要对氢气进行验纯,避免混有空气加热发生爆炸,在F处收集氢气验纯;
故答案为:收集氢气验纯;
(2)由于A中产生的H2中混有HCl和水蒸气,必须通过洗气逐一除去,防止干扰后续实验,所以B的作用是除去氢气中的氯化氢,C的浓硫酸,用于干燥氢气,
故答案为:除去氢气中的氯化氢;浓硫酸;除水蒸气或干燥氢气;
(3)装置D中发生的是氧化亚铁、氧化铁与氢气的反应,反应方程式为:3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O,H2+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+H2O,
故答案为:3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O,H2+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+H2O;
(4)U型管的质量增加的7.2g是水,物质的量是 $\frac{7.2g}{18g/mol}$=0.4mol,
设FeO、Fe2O3物质的量分别为X、Y,则:X+3Y=0.4
根据质量可列式:72X+160Y=23.2
解得Y=0.1,X=0.1,
所以氧化铁的质量为:160g/mol×0.1mol=16g,
故答案为:16;
(5)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,Fe2O3的质量将偏大,
故答案为:防止空气中水蒸气等气体进入E中;偏大;
(6)若反应后得到的残留固体中还有少量FeO,即上式中X偏小,则Y偏大,测得的Fe2O3质量将偏大,
故答案为:偏大.
点评 本题考查了测定FeO和Fe2O3固体混合物中Fe2O3的质量,是一道综合实验题,解题的关键是掌握各种装置的作用,并能根据相关的数据进行计算,此题对训练学生思维能力有一定帮助,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ①③④⑥ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI悬浊液中存在平衡:AgI(s)?Ag+(aq)+I-(aq) | |
| B. | 25℃时,向AgCl的悬浊液中加入NaCl固体,AgCl的溶度积常数不变 | |
| C. | 向含KCl、NaI的混合溶液中滴入AgNO3溶液,一定先析出AgI沉淀 | |
| D. | 用等体积的水和氯化钠溶液分别洗涤AgCl沉淀,水洗造成的AgCl损耗大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com