
分析 (1)煤炭与水蒸气在高温下反应生成一氧化碳和氢气,根据反应物、生成物和反应条件写出相应的化学反应方程式,根据反应条件判断该反应的反应热;
(2)常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数分解、置换以及某些复分解反应(如铵盐和强碱).
解答 解:(1)煤炭与水蒸气在高温下反应生成一氧化碳和氢气,反应方程式为C+H2O(g)=$\frac{\underline{\;高温\;}}{\;}$CO+H2,该反应是以碳为还原剂的氧化还原反应,故为吸热反应,
故答案为:C+H2O(g)=$\frac{\underline{\;高温\;}}{\;}$CO+H2;吸热反应;
(2)③高锰酸钾制取氧气、⑥Ba(OH)2.8H2O与NH4Cl反应、⑧碳与二氧化碳反应都是吸热反应,①酸碱中和反应、②物质燃烧、④锌与稀盐酸反应、⑤铁的生锈、⑦炸药爆炸都是放热反应,
故答案为:③⑥⑧;①②④⑤⑦.
点评 本题考查吸热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,题目难度不大,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①②③④⑤ | C. | ②⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X.Y形成的最简单化合物的稳定性:X>Y | |
| B. | Z位于元素周期表的第三周期第IA族 | |
| C. | Q与R两元素组成的分子构型是正四面体型 | |
| D. | X、Y最多可以形成5种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 要除去乙烷中混有的乙烯气体可将混合气体通过盛有酸性高猛酸钾溶液的洗气瓶 | |
| D. | 用分液漏斗可以分离溴和CCl4、苯和水、乙酸和乙醇等液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,系统命名的名称为2,3-二甲基-2-丁烯.
,系统命名的名称为2,3-二甲基-2-丁烯.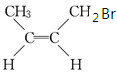 反式
反式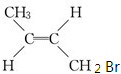 若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.
若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH3 | B. | (CH3)3COH | C. | CH3CH(OH)CH2CH3 | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
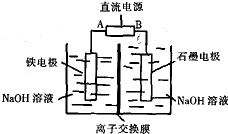 高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:
高铁酸钠(Na2FeO4)是一种新型多功能材料,工业上Na2FeO4制备方法是以纯铁棒与石墨电极为工作电极,用有隔膜的电解槽(如图所示),电解浓NaOH溶液制备高铁酸钠,化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
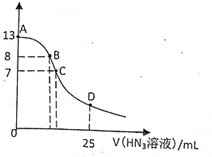
| A. | 水电离出的c(H+):A点小于B点 | |
| B. | 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(N3-) | |
| C. | 在C点,滴加的V(HN3)=12.5 mL | |
| D. | 在D点,c(Na+)=2c(HN3)+2 c(N3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com