
【题目】决定乙酸化学特性的官能团是( )
A. -OH(羟基) B. -CH3(甲基)
C. -COOH(羧基) D. C=O(碳氧双键)
科目:高中化学 来源: 题型:
【题目】葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g) ![]() 6CO2(g)+6H2O(l) ΔH=2800 kJ mol1
6CO2(g)+6H2O(l) ΔH=2800 kJ mol1
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算:
(1)100 g葡萄糖在人体内完全氧化时所产生的热量为_______________。
(2)人的体温一般要保持在36.5°C,低于此温度则要“打寒战”,并靠消耗葡萄糖释放出的能量来维持体温,与此同时有一部分能量转化为ATP。若形成 1 mol ATP需消耗10.75 g葡萄糖,则“打寒战”时会有________ %的能量转化成热量。(已知形成1 mol ATP需消耗75.24 kJ的能量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

反应的热化学方程式为____________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJmol1,H—H键的键能是436.0 kJmol1, N—H键的键能是391.55 kJmol1,则![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)
H2(g)NH3(g)
ΔH=_____________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)CO2(g) ΔH1=393.5 kJmol1
② 2H2(g)+O2(g)2H2O(l) ΔH2=571.6 kJmol1
③ 2C2H2(g)+5O2(g)4CO2(g)+2H2O(l) ΔH3=2599 kJmol1
298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g)2Al2O3(s) ΔH1
4Fe(s)+3O2(g)2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是_____________。
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是( )
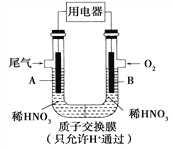
A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O===NO![]() +4H+
+4H+
C. 电极B附近的c(NO![]() )增大
)增大
D. 该电池工作时,每转移4 mol电子,生成22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+![]() O2(g)===SO2(g)+H2O(g) ΔH1
O2(g)===SO2(g)+H2O(g) ΔH1
②S(g)+O2(g)===SO2(g) ΔH2
③S(g)+H2(g)===H2S(g) ΔH3
则“2H2(g)+O2(g)===2H2O(g) ΔH4”中ΔH4的正确表达式为( )
A. ΔH4=![]() (ΔH1+ΔH2-ΔH3) B. ΔH4=2(ΔH1-ΔH2+ΔH3)
(ΔH1+ΔH2-ΔH3) B. ΔH4=2(ΔH1-ΔH2+ΔH3)
C. ΔH4=(ΔH1-ΔH2+ΔH3) D. ΔH4=![]() ΔH1-2(ΔH2-ΔH3)
ΔH1-2(ΔH2-ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学键及化合物的分类完全正确的一组是
A. MgCl2与NaOH均既含离子键又含共价键,均属离子化合物
B. BaCO3与H2SO4化学键类型不完全相同,均属强电解质
C. 乙醇与醋酸,均只含共价键,均属非电解质
D. 氯气与氧气,均只含共价键,均只做氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ节选]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为____________________________、____________________________,制得等量H2所需能量较少的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A. 0.1(b-2a)mol/L B. 10(2a-b)mol/L
C. 10(b-a)mol/L D. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是
 :
:
A.a线代表的是PbCO3
B.T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5。
C.T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
D.T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com