
H2CO3的电离平衡常数Ka1=4.3×10-7,Ka2=5.6×10-11,它的Ka1、Ka2差别很大的原因(从电离平衡的角度解释):_________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有关氢键的叙述正确的是( )
A.每一个水分子内平均含有两个氢键
B.氢键与配位键一样,也是共价键的一种
C.氢键是导致浓硫酸具有粘稠性原因之一
D.由于H2O中含有氢键,因此水是一种非常稳定的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2 mol·L-1·min-1
B.6~10 min的平均反应速率:
v(H2O2)<3.3×10-2 mol·L-1·min-1
C.反应到6 min时,c(H2O2)=0.30 mol·L-1
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH<0。已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的表中。
| 实验编号 | T(℃) | NO初始浓度(mol·L-1) | CO初始浓度(mol·L-1) | 催化剂的比表面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
(1)请填全表中的各空格;
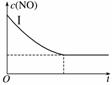
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如右图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将a mol·L-1 CH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 mol·L-1醋酸溶液、0.1 mol·L-1盐酸、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。
(1)甲取出10 mL 0.1 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是__________________________,
理由是________________________________________________________________________。
(2)乙分别取pH=3的醋酸和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是________________________________________________________________________。
(3)丙分别取pH=3的盐酸和醋酸各10 mL,然后加入质量相同的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?________,请说明理由:_____________________________。
(4)丁用CH3COONa晶体、NaCl晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)________(填“大于”、“小于”或“等于”)pH(乙)。若将甲、乙两溶液等体积混合,溶液的pH=__________。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)________(填“大于”、“小于”或“等于”)V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)________(填“大于”、“小于”或“等于”)c(CH3COO-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com