
 .
. .
. 分析 化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C,说明A中含有酯基,B的分子式为C2H4O2,分子中只有一个官能团,所以B是乙酸,乙酸和乙醇能发生酯化反应生成乙酸乙酯D;C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,根据C中碳氢氧的含量确定其分子式;C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,说明该支链上含有碳碳双键和羧基,另外两个取代基相同,分别位于该取代基的邻位和对位,根据C中原子个数确定该取代基名称,根据B和C物质确定A物质名称,从而写出其结构简式.
解答 解:(1)化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C,说明A中含有酯基,B的分子式为C2H4O2,分子中只有一个官能团,所以B的结构简式是CH3COOH,能发生银镜反应的,说明B的同分异构体中含有醛基,则结构简式为HOCH2CHO、HCOOCH3,
故答案为:HOCH2CHO、HCOOCH3;
(2)C是芳香化合物,说明C中含有苯环,相对分子质量为180,其碳的质量分数为60.0%,则含碳原子个数为$\frac{180×60.0%}{12}$=9,氢的质量分数为$\frac{180×4.4%}{1}$=8,其余为氧,则O原子个数为$\frac{180×(1-60.0%-4.4%)}{16}$=4,则C的分子式是C9H8O4,
故答案为:C9H8O4;
(3)C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团说明含有碳碳双键;能与碳酸氢钠溶液反应放出气体的官能团,说明含有羧基;另外两个取代基相同,根据分子式,可推算出另外的官能团为羟基;其分别位于该取代基的邻位和对位,则C的结构简式是 ,
,
故答案为: ;
;
(4)A能水解再酸化生成B和C,根据B和C的结构简式知,A的结构简式是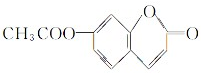 ,
,
故答案为: .
.
点评 本题考查有机物的推断,明确物质含有的官能团及其性质是解本题关键,难点是同分异构体的书写.


科目:高中化学 来源: 题型:选择题

| A. | 铜是负极,铜片上有气泡产生 | |
| B. | 铜片是正极,该电极周围溶液pH不变 | |
| C. | 电子流从锌片经导线流向铜片 | |
| D. | 氢离子在锌片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠固体 | B. | 硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量Na2O2粉末加入到H218O水中:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| B. | 向AlC13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 氯化亚铁溶液中通入足量C12:Fe2++C12═Fe3++2C1- | |
| D. | 往NH4HSO4溶液中加入足量NaOH溶液:NH4++H++2OH-═NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
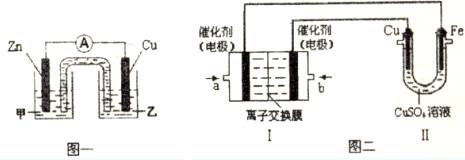
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
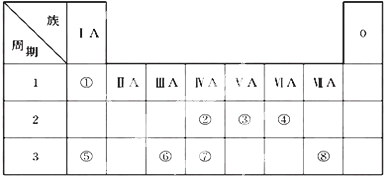
 或
或 .
.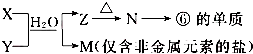
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子第五电子层只有2个电子,则该原子第四电子层的电子数肯定为8或18个 | |
| B. | 核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 | |
| C. | R为第二周期元素,其原子具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有 ①RO${\;}_{3}^{2-}$、②R2O${\;}_{4}^{2-}$、③RO${\;}_{4}^{2-}$ | |
| D. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

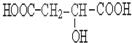 请回答:
请回答: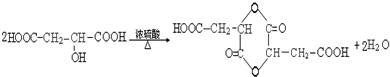 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
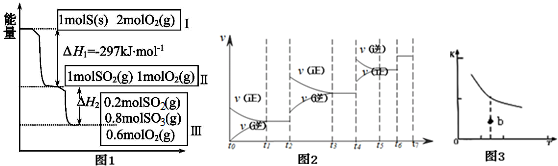
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com