
【题目】草酸晶体 (H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4 = CO2↑+CO↑+H2O 某课外活动小组的学生设计了如下实验装置,用来制取干燥纯净的 CO 气体,并用生成的 CO 气体还原 FexOy 制取铁粉。

(1)装置 B 的作用是_____。装置 E 中的现象是_________。装置 F 的作用是_________。
(2)装置 D 中玻璃管中发生反应的化学方程式为_____。
(3)若 FexOy 为 0.4g,生成的气体与过量澄清石灰水反应生成 0.75g 白色沉淀,则 FexOy 的化学式为_____。
(4)在实验开始时,点燃A、D 酒精灯的先后顺序是_____,实验完毕后,熄灭A、 D酒精灯的先后顺序是_____。
【答案】除去二氧化碳,防止对后面的实验造成干扰 澄清石灰水变浑浊 处理尾气,防止污染空气 FexOy + yCO ![]() xFe + yCO2 Fe2O3 先点燃酒精灯 A,再点燃酒精灯 D 先熄灭酒精灯 D,再熄灭酒精灯 A
xFe + yCO2 Fe2O3 先点燃酒精灯 A,再点燃酒精灯 D 先熄灭酒精灯 D,再熄灭酒精灯 A
【解析】
(1)根据氢氧化钠溶液能与二氧化碳反应考虑;根据一氧化碳有毒能污染空气和澄清石灰水能验证二氧化碳考虑;
(2)反应物为FexOy和CO,生成物为Fe和CO2,根据化学质量守恒定律,即化学反应前后,原子的种类和数目不变配平;
(3)依据C元素守恒关系可得:CO~CO2~CaCO3,FexOy中氧的质量为:m(CO2)-m(CO),根据碳酸钙的量可计算出该氧化物中氧元素的物质的量、质量,然后根据该氧化物的质量计算出铁元素的质量,最后计算出铁元素与氧元素的物质的量之比即可;
(4)根据可燃性气体与空气混合加热时容易发生爆炸分析。
(1)由于二氧化碳与氢氧化钠反应生成碳酸钠和水,所以氢氧化钠溶液的目的是吸收混在一氧化碳中的二氧化碳,E装置中发生反应的反应物是FexOy和一氧化碳,生成物是铁和二氧化碳,因此E中的现象是:澄清石灰水变浑浊;由于一氧化碳有毒能污染空气,所以将一氧化碳点燃进行尾气处理,防止污染空气。故答案为:除去二氧化碳,防止对后面的实验造成干扰;澄清石灰水变浑浊;处理尾气,防止污染空气 ;
(2)装置D中发生一氧化碳还原氧化铁的反应,反应的化学方程式为:FexOy+yCO![]() xFe+yCO2;故答案为:FexOy + yCO
xFe+yCO2;故答案为:FexOy + yCO ![]() xFe + yCO2;
xFe + yCO2;
(3)依据C元素守恒关系可得:CO~CO2~CaCO3, 0.75g白色沉淀为碳酸钙,则:n(CaCO3)=n(CO)=0.75g÷100g/mol=7.5×10-3mol,则FexOy中氧元素的质量为:m(CO2)-m(CO)=44g·mol-1×7.5×10-3mol-28g·mol-1×7.5×10-3mol=0.12g,0.4g FexOy中铁元素的物质的量为:n(Fe)=(0.4g-0.12g)÷56g/mol=0.005mol,0.4g FexOy中氧元素的物质的量为:n(O)=0.12g÷16g/mol=0.0075mol,则:x:y=0.005mol:0.0075mol=2:3, FexOy的化学式为Fe2O3;故答案为:Fe2O3
(4)在实验开始时,先点燃A,生成CO,通过D装置,排尽空气,防止可燃性气体与空气混合加热时发生爆炸;在实验结束时,先关闭D,防止A装置发生倒吸。故答案为:先点燃酒精灯 A,再点燃酒精灯 D;先熄灭酒精灯 D,再熄灭酒精灯 A


科目:高中化学 来源: 题型:
【题目】(1)烷烃A在同温、同压下蒸气的密度是H:的43倍,其分子式为____分子中含102个氢原子的烷烃的分子式是_____
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__种。
(3)有机物 的正确命名为___________
的正确命名为___________
(4)立方烷 它的六氯代物有____种。
它的六氯代物有____种。
(5)  分子中最多有个____原子共面.
分子中最多有个____原子共面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏伽德罗常数.下列说法正确的是( )
A. 标准状况下, 22.4LCCl4 中含有的分子数为 NA
B. 1 mol/L FeCl3 溶液中含有 3NA 个 Cl-
C. CO 和 N2组成的混合物 28g 共含有原子数为 2 NA
D. 0.5molKClO3中含有Cl-的数目为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________(填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )

①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→⑧;⑦→⑥;⑤→④;
③C装置原理上是一个电镀池(Ag表面镀Cu),期中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A. ③④ B. ①② C. ②③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。

回答下列问题:
(1)题中通入CO2后所得溶液的溶质成分为______________,若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为_____。
(2)原NaOH溶液的物质的量浓度为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
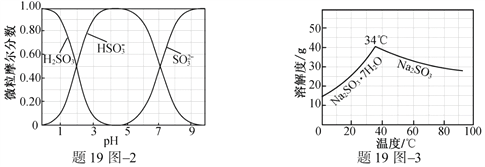
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是

A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com