
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
分析 用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2.
Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2,与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;
Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2,通入足量氯气,反应生成FeCl3;
Ⅳ.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.据此分析.
解答 解:用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2.
Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2,与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;
Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2,通入足量氯气,反应生成FeCl3;
Ⅳ.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)铜与氯化铁反应生成氯化铁、氯化亚铁,化学方程式为:2FeCl3+Cu═2 FeCl2+CuCl2,所以离子方程式是Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)试剂A只能将铁反应掉,不反应铜,且不能引入杂质离子,故A为盐酸,故答案为:盐酸;
(3)在滤液中加入KSCN溶液,溶液变血红色,说明滤液中有Fe3+,在滤液中加入酸性KMnO4,如果紫红色褪去,说明溶液中存在亚铁离子,故答案为:
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入 c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入 a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
点评 本题考查了氯化铁来腐蚀电路铜板的反应和所需试剂的推导,难度不大,应注意的是由溶液获得带结晶水的晶体的方法.


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
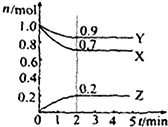 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、K+、SO42-、MnO4- | |
| B. | pH=1的溶液中:Fe2+、SO42-、Cl-、NO3- | |
| C. | 使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+、 | |
| D. | 水电离出的c(H+)=1×10-12mol/L的溶液:K+、Cl-、Ba2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- | |
| B. | 能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- | |
| C. | 常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、NO3-、Fe3+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向以上平衡体系中加入足量浓NaOH溶液,两平衡都向右移动,Al(OH)3的质量增加 | |
| B. | 向以上平衡体系中加入足量浓盐酸,Al3+的物质的量增加 | |
| C. | 在同一溶液中,Al3+与OH-能大量共存 | |
| D. | 在同一溶液中,AlO2-与H+能大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com