

| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | (CH3)2CHCH3 | D. | CH3CH2CHO |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
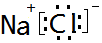 .
.| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )| A. | 2,3-二甲基-1,3-丁二烯和乙烯 | B. | 2,3-二甲基-1,3-丁二烯和乙炔 | ||
| C. | 1,3-丁二烯和2-丁炔 | D. | 1,3-丁二烯和2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 卤族元素的最高正化合价等于其主族序数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| D. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 氮元素的非金属性强于磷,在常温下氮气活泼性也强于磷 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| D. | 二氧化硫和次氯酸的漂白原理不同,二氧化硫漂白时没有发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com